RADIOLOGIA
DIAGNOSTICA Y TERAPEUTICA:
ABLACION
SELECTIVA DE FOCOS TUMORALES MICROSCOPICOS CON LASER
Dr. Edgardo Marecos (h)
Ex-Research Fellow en
Radiología del Massachusetts General Hospital y Harvard Medical
School
Este novel
estudio del tratamiento de las masas tumorales se basa en la capacidad
de las células tumorales de absorber in vivo partículas
absorbentes de energía
detectables por resonancia magnética
y la posibilidad de destruirlas selectivamente con pulsos de láser
con mínimos efectos secundarios sobre las células normales
adyacentes.
La idea
principal de este tipo de aproximación diagnóstico-terapéutica
es la del uso como coadyudantes del neurocirujano, quien luego de la resección
de la masa tumoral, coloca al paciente dentro de un resonador de tipo abierto
para observar primero el área todavía no resectada (observable
gracias a la presencia del agente de contraste) y la posterior irradiación
de la zona con la consiguiente destrucción de los focos satélites
localizados en la periferia del tumor en áreas de tejido cerebral
normal , con función cerebral todavía conservada.
En esta
presentación enfocaremos en el tratamiento de los tumores cerebrales
debido a que el tratamiento mínimamente invasivo es altamente deseado
en patologías de este tipo (en las que la conservación del
máximo de función cerebral normal adyacente al tumor es vital)
aunque el método también puede ser utilizado en otros tumores
o tejidos no tumorales. Los tumores del sistema nervioso central representan
aproximadamente un 2-5 % de todos los tumores. Un 80% se localizan a nivel
del cerebro de los cuales un 50% son gliomas. A pesar del desarrollo de
la radio- y quimioterapia como coadyudantes de la cirugía el pronóstico
general es sombrío.
Los óxidos
de hierro también denominados MION (monocrystalline iron
oxides nanoparticles) fueron originalmente desarrollados como agentes
de contraste para resonancia magnética en el Center for Molecular
Imaging Research del Massachusetts General Hospital bajo la
dirección del Dr. Ralph Weissleder (1). Por medio de estudios posteriores
se descubrió que pueden ser potencialmente utilizadas tanto para
fines diagnósticos como terapéuticos.
Estas
partículas consisten en un cuerpo central monocristalino formado
por 2.000 átomos de Fe de 4 nn de diámetro al cual
se anclan múltiples moléculas de dextrano lo que les otorga
un peso molecular de aproximadamente 11.000 (ver figura 1). Estas moléculas
de dextrano que rodean a la superficie del compuesto aumentan el radio
hidrodinámico del compuesto hasta 25 nn. Estudios in vivo
realizados en el pasado han demostrado que el MION pueden penetrar
a través del endotelio capilar y localizarse en las células
tumorales por medio del proceso de endocitosis de fase fluida (2). El estudio
de la distribución intratumoral del compuesto en un modelo murino
de gliosarcoma demostró que la relación de distribución
entre células de tejido normal y tumoral es de 10 a 1 con un valor
absoluto de 0,1 % de la dosis inyectada por gramo de tejido tumoral (3,7).
En el interior del tumor, aproximadamente una mitad (49%) se localiza en
las células tumorales, 21 % en los macrófagos y un 6.5% en
las células endoteliales (3).
Por medio
de estudios realizados en nuestro laboratorio para alcanzar una mayor concentración
de átomos de hierro en el interior celular (necesaria para alcanzar
una tasa de letalidad suficientemente importante) se observó que
la modificación de la molécula de MION con la incorporación
de un péptido (portador de una señal de translocación
de membrana) derivado del VIH (virus de la inmunodeficiencia humana)
(denominado por nuestro laboratorio como CLIO-TAT) lleva al incremento
de 100 veces en la capacidad de internalización del compuesto a
linfocitos murinos y células de gliosacoma murino (4).
Estudios
paralelos realizados por los Wellman Laboratories of Photomedicine
también del Massachusetts general Hospital (5) han demostrado
que las células pigmentadas del cuerpo pueden ser selectivamente
aniquiladas por medio de pulsos cortos de láser tanto in vitro
como in vivo (esta técnica está siendo actualmente
utilizada para el tratamiento de enfermedades de la piel, nevos pigmentadas
así como también para la remoción de pelos y tatuajes
(6)) .Con la excepción de los tatuajes, este procedimiento se basa
en la deposición de energía a través del láser
a pigmentos intrínsecos absorbentes de luz como la
hemoglobina y la melanina. Nuestra aproximación a la ablación
selectiva de tumores se basa sobre esta técnica por medio del uso
del CLIO-TAT como nanopartícula pigmentada
extrínseca
(aunque internalizada) absorbente de luz en lugar del uso de las partículas
intrínsecas antes mencionadas.. El mecanismo básico
de la interacción partícula-luz y la destrucción
celular inducida por láser han sido recientemente dilucidados (6):
consiste en el calentamiento transitorio rápido de las partículas
pigmentadas intracelulares que produce la evaporación de las moléculas
de agua ubicadas a su alrededor ocasionando una explosión denominada
microcavitación (6) con la consecuente muerte de las células
que contienen las partículas sin efecto sobre las células
adyacentes que no las contienen (6)
Experimentos in vitro
Para
estudiar la factibilidad de la destrucción selectiva de células
tumorales, células de glioma murino 9L fueron incubadas in vitro
durante una hora a distintas concentraciones (5, 25, 50 y 100 µg
[Fe] ) de CLIO-TAT para permitir la incorporación del compuesto.
Previo a la irradiación, las células fueron transferidas
a un medio de cultivo libre del compuesto y calceína fluorescente
fue adicionada para marcar las células viables (la presencia de
fluorescencia en el interior de las células es sinónimo de
viabilidad celular, ver figura 2). El cultivo fue posteriormente irradiado
con pulsos de láser de 20 ns en el espectro de los 523 nm (a razón
de 10-100 pulsos por campo; fluencia: 0.5 J/cm2). El procedimiento
fue realizado en un microscopio con iluminación estroboscópica
para observar la microcavitación inducida por los pulsos de láser
(ver figura 3). El porcentaje de letalidad in vitro fue de alrededor
del 100% inmediatamente después del procedimiento. (en procedimientos
paralelos 0% de las células no marcadas fueron destruidas)
Experimentos in vivo
Ratas
Fischer 344 fueron utilizadas para demostrar la factibilidad de su visualización
por resonancia magnética (ver figura 4). Los animales fueron inmovilizados
en un cuadro estereotáctico, anestesiados e implantados con una
suspensión de células de gliosarcoma murino 9L a nivel del
caudo-putamen. Un set de ratas fueron inyectadas con CLIO-TAT marcado
con Indio 111 para realizar estudios de biodistribución del compuesto;
de estos resultados se dedujo que la relación entre tejido tumoral
y tejido cerebral normal era de 10 a 1 lo que es importante en la selectividad
que se necesita alcanzar.
Paralelamente
un grupo de ratas fueron implantadas intracerebralmente con células
marcadas con CLIO-TAT previa irradiación para demostrar la no viabilidad
de las mismas gracias a la acción de los pulsos de láser.
Discusión
La modificación
del MION con la incorporación del péptido Tat derivado
del VIH permite una incremento suficiente en la concentración de
átomos de hierro necesarios para lograr la inducción de microcavitación
en el interior de la célula tumoral. La incorporación del
compuesto a células endoteliales (debido a la propiedad del MION
de ser incorporado a las células en rápida proliferación)
es un punto que debe ser más ampliamente estudiado para lograr una
mayor selectividad.
Con estos
estudios de factibilidad efectuados hasta el momento es evidente que este
tipo de aproximación a la destrucción selectiva de los tumores
es un área que debe ser estudiada más ampliamente.
La deposición
de energía a las células es un método cada vez más
comúnmente utilizado para la destrucción de células.
Actualmente, diversas terapias tales como la terapia fotodinámica
están siendo estudiadas en laboratorios y ensayos clínicos
como complemento de la resección quirúrgica y/o radio / quimioterapia
de las neoplasias intracraneales. Comparado con la terapia fotodinámica,
este método produce destrucción celular mediante interacciones
mecánicas y térmicas en lugar de la producción de
reacciones químicas especiales (formación de radicales libres)
por lo que no es afectada por la hipoxia tisular la cual es una de las
mayores limitaciones de la terapia fotodinámica. Este método
es
también diferente de la hipertermia convencional con láser
(utilizada actualmente) que usa pulsos largos o continuos y que se basa
en la conducción de calor para la destrucción de las
masas tumorales.

Figura 1. Estructura molecular del MION. Véase el núcleo central formado por átomos de hierro rodeado de una capa de dextranos.
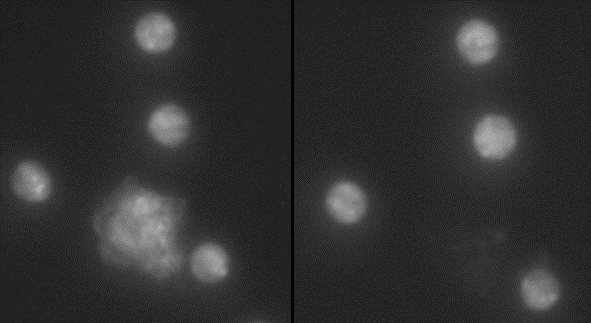
Figura 2. Linfocitos
(células de forma redonda) y célula de gliosarcoma murino
9L (irregular) con CLIO-TAT en su interior, observadas bajo microscopio
de fluorescencia. Obsérvese la destrucción después
de la irradiación con pulsos de láser (antes, izquierda:
después, derecha)

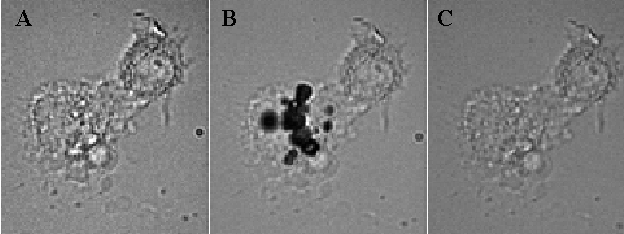
Figura 3. Imagen estrosboscópica típica de una célula de gliosarcoma murino 9L marcada con MION-In111 modificado (A) antes, (B) 45 nanosegundos después del pulso de láser y (C) después del colapso de la microcavitación.
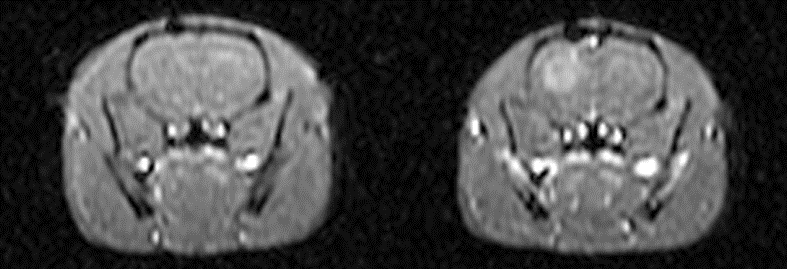
Figura 4. Resonancia
magnética de tumor intracerebral de gliosarcoma murino 9L antes
(izquierda) y 24 hrs después (derecha) de la inyección intravenosa
de CLIO-TAT.
BIBLIOGRAFIA
1.Weissleder R, Papisov
M. Pharmaceutical iron oxides for MR imaging. Journal of Magnetic Resonance
Imaging, 1992;4: 1-20
2.Moore A, Weissleder R,
Bogdanov A. Uptake of dextran-coated monocrystalline iron oxides in tumor
cells and macrophages. JMRI, 1997; 7:1140-1145
3. A Moore,
E Marecos, R Weissleder, A Bogdanov, Jr. Macro and microscopic tumoral
distribution of long circulating iron oxide nanoparticles. Radiology
214 (2): 568-574, Feb 2000.
4. Bhorade R, Weissleder
R, Nakakoshi T, Moore A, Tung CH. Macrocyclic chelators with paramagnetic
cations are internalized into mammalian cells via a HIV-Tat derived membrane
translocation peptide. Bioconjugate Chemistry, 2000;11:301-305
5. Anderson
RR, Parrish JA, Selective photothermolysis, Science 220:524 (1983).
6. Lin CP, Kelly MW.
Cavitation and acoustic emission around laser-heated microparticles.
Appl. Phys. Lett, 72:2800 (1998).
7. Moore A, Weissleder R,
Bogdanov A Jr, Uptake of dextran-coated monocrystalline iron oxides in
tumor cells and macrophages. J Magn Reson Imaging 7:1140-5 (1997).
8. Intracellular magnetic
labeling of lymphocytes for in vivo trafficking studies. U Schoepf, E Marecos,
R Melder, RK Jain, and R Weissleder. BioTechniques. 24 (4): 642-651, Apr
1998.