Revista
de Posgrado de la Cátedra VIa Medicina N° 106 - Julio/2001
Página:
13-18
MIOCARDIOPATIA
HIPERTROFICA: Revisión
Dra. Aydée Burgos
Fleitas, Dra. María Stella Cicono García.
Dra. Graciela González
Bogado. Dr. Carlos Vega López
Servicio de Ecocardiografía.
IPS. Asunción - Paraguay
INTRODUCCION
La miocardiopatía
hipertrófica (MCH) es una enfermedad cardíaca primaria con
diversa expresión clínica y genética, y una evolución
variable(1). Se caracteriza por una hipertrofia ventricular simétrica
o asimétrica, con o sin obstrucción al tracto de salida del
ventrículo izquierdo (TSVI), en ausencia de enfermedad cardíaca
o extracardíaca capaz de producirla. La prevalencia de esta patología
es baja, de 0.02 a 0.2 % de la población. La MCH es la causa más
frecuente de síncope inducido por el estrés o de muerte súbita
(MS) de origen cardíaco en pacientes menores de 30 años,
incluyendo atletas competitivos (2-4). A menudo no hay síntomas
o son mínimos y la enfermedad se detecta solo por ecocardiografía.
Actualmente la ecocardiografía bidimensional proporciona la máxima
información sobre las características morfológicas
y hemodinámicas de la enfermedad.
Etiopatogenia
Alrededor del 50 %
de los casos se trasmite genéticamente, en forma autosómica
dominante con penetrancia variable, y en el resto de los casos se debe
probablemente a mutaciones espontáneas. Se estima que en el 30 %
de los casos se debe a mutaciones del gen que codifica la cadena pesada
de la beta miosina del cromosoma 14, 15% a mutaciones del gen de la troponina
T cardiaca del cromosoma 1, menos del 3% a genes de la tropomiosina alfa
del cromosoma 15 y el resto a mutaciones de otros genes de los cromosomas
7, 11 y otros genes no identificados.
Anatomía patológica
Se caracteriza por
hipertrofia miocárdica con aumento de la masa, con cavidades ventriculares
pequeñas o no dilatadas. Las aurículas están dilatadas
y generalmente hipertrofiadas (fig. 1).
La hipertrofia predominante
del septo y pared anterolateral se observa en el 70 al 75% del total de
casos, hipertrofia solo del septum basal en 15%, hipertrofia concéntrica
en 5%, hipertrofia de la pared lateral en 1-2%, e hipertrofia apical en
menos del 5% (excepto en la población japonesa donde se observa
en el 25% de los casos). Es rara la afectación del ventrículo
derecho.
Los hallazgos microscópicos
(fig. 2) son distintivos, con hipertrofia de las fibras miocárdicas
y desorganización de los haces musculares. La fibrosis intersticial
es importante, incluso se puede observar áreas macroscópicas
de cicatrices. Las coronarias intramiocárdicas son anormales con
reducción del calibre de la luz y engrosamiento de la pared del
vaso, por proliferación mediointimal.
Diversos trastornos
muy diferentes presentan características morfológicas similares
a la MCH como el hiperparatiroidismo, lactantes hijos de madre diabética,
neurofibromatosis, lipodistrofia, feocromocitoma, ataxia de Friedreich,
síndrome de Noonan. Los hipertensos, los pacientes sometidos a hemodiálisis
y la estenosis aórtica pueden presentar hipertrofia que simula MCH.
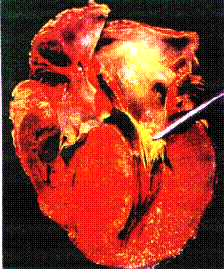
Fig. 1. Miocardiopatía
hipertrófica con hipertrofia asimétrica del tabique. El músculo
septal hace protrusión en el TSVI, la AI está aumentada de
tamaño. Se ha retirado del tabique la valva mitral anterior para
mostrar una placa endocárdica fibrosa.

Fig. 2. El aspecto histológico
muestra desorganización, hipertrofia extrema y ramificaciones peculiares
de los miocitos, así como la fibrosis intersticial característica.
Fisiopatología
La función sistólica
suele ser normal incluso hasta los estadios finales; la hipercontractilidad
es una de las características de la enfermedad. Otra característica
es la obstrucción del TSVI que se presenta en el 25% de los casos.
Esta obstrucción es dinámica y variable, pudiendo aparecer
en reposo o solamente después de maniobras de provocación
(aquellas que producen disminución de la precarga y/o postcarga
o aumento de la contractilidad). En la actualidad se cree que la obstrucción
se debe al movimiento anterior sistólico (SAM) de la válvula
mitral. La hipertrofia del tabique estrecha el tracto de salida y la expulsión
se acelera, esto genera fuerzas de Venturi arrastrando las valvas anterior
o posterior o ambas hacia el tabique. El contacto de la válvula
mitral con el tabique obstruye el TSVI en la mitad de la sístole
y en la sístole tardía. La distorsión de las valvas
mitrales puede producir insuficiencia mitral (IM).
La función diastólica
está alterada en casi todos los pacientes con MCH, independientemente
de la existencia de obstrucción o síntomas, así como
también de la extensión y distribución de la hipertrofia.
Se observa alteración de la relajación y distensibilidad
ventricular.
La isquemia es frecuente
y multifactorial, pudiendo deberse al engrosamiento y estrechamiento de
las coronarias intramurales, a la mayor demanda de oxígeno y al
aumento de la presión diastólica del ventrículo izquierdo
(VI) con isquemia subendocárdica resultante.
Manifestaciones clínicas
Los pacientes son en
su mayoría asintomáticos o levemente sintomáticos,
pero desafortunadamente la primera manifestación de la enfermedad
puede ser la MS, que ocurre a menudo en niños o jóvenes,
por lo general durante o después de un esfuerzo físico (3).
La forma sintomática puede aparecer a cualquier edad, siendo mas
frecuente entre los 30 y 50 años. El cuadro clínico es muy
variable, observándose desde un paciente asintomático con
electrocardiograma (ECG) ligeramente anormal hasta aquellos con síntomas
incapacitantes.
El síntoma mas
frecuente es la disnea, presente en el 90% de los casos, debido en gran
parte a la disfunción diastólica. Son también frecuentes
la angina de pecho presente en 75% de los casos, la fatiga, el presíncope
y el síncope. El ejercicio exacerba los síntomas. Puede presentarse
el síncope consecutivo a gasto cardíaco disminuido con el
esfuerzo por arritmias cardíacas, activación de barorreflejos
ventriculares, obstrucción al TSVI, disfunción diastólica
severa o isquemia miocárdica (5).
El examen físico
puede ser normal en pacientes asintomáticos sin gradientes. A la
auscultación el primer ruido cardiaco es normal, precedido de un
cuarto ruido, característico de un ventrículo hipertrófico
con escasa complacencia. El segundo ruido por lo general se halla desdoblado.
Es común un
tercer ruido. Se ausculta un soplo sistólico característico
áspero, crescendo-decrecendo, que se escucha mejor entre la punta
y el borde izquierdo del esternón.
Es también frecuente
auscultar un soplo sistólico de insuficiencia mitral en la punta.
En la MCH la expulsión
inicial ventricular no esta impedida, por lo cual el pulso arterial es
rápido, y no lento y tardío como en la estenosis aórtica.
Electrocardiograma
Se observa ECG normal
en el 15% de los pacientes asintomáticos y sin gradiente. Las anomalías
más comunes son alteraciones del segmento ST y de la onda T, seguidas
en frecuencia por signos de hipertrofia de ventrículo izquierdo
(HVI) con complejos QRS mas altos en la derivaciones mesoprecordiales.
La forma apical se
caracteriza por ondas T negativas gigantes en las derivaciones mesoprecordiales.
Las ondas Q prominentes son comunes, se presenta en el 20-50% de los casos
y generalmente se observa en las derivaciones inferiores (II,III y AVF)
y en las precordiales (V2-V6). Las arritmias ventriculares son frecuentes,
se observa en más del 75% de los pacientes sometidos a Holter. En
25% de los pacientes se encuentra taquicardia ventricular no sostenida,
en 25-50 % taquicardia supraventricular y en 10 % de los casos fibrilación
auricular.
Radiografía de tórax
La silueta cardíaca
puede variar desde lo normal hasta muy aumentada y en la mayor parte de
los casos, la cardiomegalia aparente, es el resultado de HVI y/o agrandamiento
de la aurícula izquierda. No se observa dilatación de la
raíz aórtica ni calcificación valvular aórtica.
Ecocardiografía
Es útil en el
estudio de los pacientes con sospecha de MCH y para la detección
de los familiares de enfermos con MCH.
Modo M.
En la vista paraesternal
eje largo o eje corto se puede observar hipertrofia septal asimétrica
(definida como relación septum/pared posterior mayor de 1:1.3),
con un espesor parietal generalmente mayor de 15 mm, aunque puede ser menor.
Para determinar el espesor septal se utiliza el modo M guiado por la ecocardiografía
bidimensional, teniendo presente que el corte debe ser perpendicular al
septum y no tangencial, y con buena delineación del endocardio,
evitando la inclusión de las trabéculas del ventrículo
derecho en el espesor septal. Si la imagen es buena también se puede
utilizar la ecocardiografía bidimensional para medir el espesor
parietal La ecogenicidad anormal del septum es frecuente, con movimiento
septal disminuido. La cavidad ventricular izquierda es pequeña,
con movimiento normal o aumentado de la pared posterior. El modo M es el
más indicado para identificar el SAM de la válvula mitral,
dada la excelente resolución temporal que presenta.(fig. 3). Además
se puede observar prolapso de la válvula mitral y el cierre mesosistólico
o fluter sistólico de la válvula aórtica.
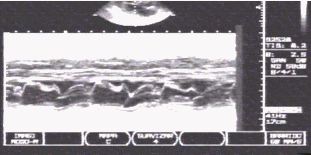
Fig. 3. Ecocardiografía
Modo M donde se observa hipertrofia septal y SAM.
Modo bidimensional.
Permite cuantificar
la magnitud, localización y extensión de la hipertrofia.
En la vista paraesternal eje largo, especial observación debe realizarse
a nivel del septum posterobasal (comprendido entre la válvula mitral
y los músculos papilares) que generalmente no está hipertrofiado
en la MCH, y sí en otras formas de hipertrofias, como en la hipertensiva
(6).
También debe
diferenciarse la protrusión del septum basal en el TSVI que se observa
en pacientes de mayor edad, y que se debe a la tortuosidad de la aorta
con un ángulo más agudo entre el septum basal y la raíz
aórtica, y que no debe considerarse como MCH. Las vistas apicales
permiten la visualización de las características y extensión
de la hipertrofia. En la vista eje largo paraesternal se puede observar
el SAM de la válvula mitral (fig. 4). También puede observarse
SAM sin evidencia de MCH: en la insuficiencia aórtica, IM, hipovolemia,
estimulación por inotrópicos, hipertrofia concéntrica
del VI, hipertensión arterial, entre otros, aunque no es frecuente.
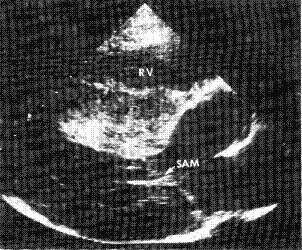
Fig. 4. ecocardiografía
2D vista paraesternal eje largo donde se observa hipertrofia septal marcada
con obstrucción al TSVI y SAM.
Doppler espectral.
Permite cuantificar
el grado de obstrucción a nivel del TSVI. La obstrucción
es dinámica y no siempre está presente en reposo. Pueden
ser necesarias maniobras de provocación (maniobra de valsalva, nitrito
de amilo, isoproterenol, o ejercicio) para desencadenar el SAM que está
ausente en reposo y evidenciar la obstrucción. La obstrucción
dinámica no solo se produce en la hipertrofia septal asimétrica
, también la hipertrofia concéntrica puede producir obstrucción
del TSVI. La severidad de la obstrucción depende de la precocidad
y duración del contacto mitroseptal, de la disminución del
diámetro del TSVI, y del ángulo entre el eje del tracto de
salida y las valvas mitrales. La morfología típica del flujo
del TSVI presenta un pico sistólico tardío en forma de daga;
puede observarse un flujo holosistólico, que se relaciona con formas
más severas de obstrucción. (fig. 5).
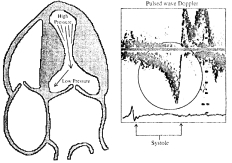
Fig. 5. Flujo
sistólico tardío en forma de daga a nivel del TSVI.
Para identificar el
sitio de obstrucción con precisión se recomienda usar siempre
el Doppler pulsado con frecuencia de repetición de pulsos (PRF)
alta, rastreando desde la zona apical hacia el TSVI (6). El Doppler continuo
también muestra un jet de alta velocidad con pico sistólico
tardío, a nivel de la obstrucción. Además, es importante
no confundir el flujo mitral con el flujo del TSVI, el flujo de la insuficiencia
mitral es más precoz y de mayor velocidad, y con la utilización
del Doppler pulsado podemos evitar el error. La IM es un hallazgo frecuente
y si existe obstrucción prácticamente puede detectarse en
todos los pacientes. Lo habitual es que sea leve a moderada. El SAM hace
que la coaptación de las valvas sea incompleta y en el 90% de los
casos aparezca un jet excéntrico y posterior. El 20 % de los pacientes
tienen IM independientemente de la obstrucción, la cual es secundaria
a otras anormalidades (prolapso del válvula mitral, calcificación
del anillo mitral, enfermedad reumática o posición anormal
de los músculos papilares). Como consecuencia de la IM o de una
distensibilidad anormal del VI la aurícula izquierda puede sufrir
un agrandamiento significativo.
A nivel de la válvula
mitral el patrón de llenado del VI muestra patrones variables, el
más típico es el patrón de relajación prolongada,
pero también se puede observar el patrón pseudonormal y el
patrón restrictivo, y no guarda relación con la gravedad
de la hipertrofia, ni con la gravedad de la obstrucción. (fig. 6).
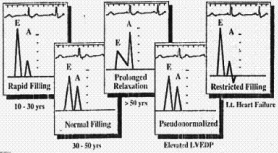
Fig. 6. Patrones
variables de flujo mitral en la MCH.
Doppler color.
Ayuda a localizar la
obstrucción. Se observa aceleración del jet proximal al área
del contacto mitroseptal y un marcado estrechamiento en el punto donde
éste se produce. Además permite valorar la gravedad de la
IM.
Ecocardiografía transesofágica
(ETE). Proporciona una mejor visualización de las estructuras en
estudio.
Los pacientes con fibrilación
auricular y MCH tienen riesgo de embolización a partir de trombos
localizados en la orejuela izquierda. La ETE es importante para confirmar
su presencia y evaluar la anticoagulación. Es útil para planificar
la cirugía y para controlar durante el acto quirúrgico la
eficacia de la miectomía. Además post-bypass, permite alertar
al cirujano sobre posibles complicaciones como comunicación interventricular,
aire en las coronarias o resolución incompleta de la obstrucción.
La ecocardiografía
peroperatoria epicárdica con transductor estéril también
puede ser útil para controlar si la miectomía es eficaz.
Evaluación de tratamiento médico
y quirúrgico.
Con el Doppler puede
observarse mejoría de la función diastólica y de la
obstrucción dinámica del TSVI, con el tratamiento médico.
También se puede observar la ausencia del SAM en el postoperatorio
y el sitio de la miotomía-miectomía con ensanchamiento del
TSVI; el Doppler color muestra desaparición del jet turbulento del
TSVI y la desaparición o mejoría de la IM.
Limitaciones técnicas.
En algunas situaciones,
se puede observar un ventrículo hipertrófico hiperdinámico
con obliteración mediocavitaria y gradiente intraventricular sin
tratarse de una MCH. La distinción entre un miocardio hipertrófico
hiperdinámico y una MCH puede realizarse teniendo en cuenta los
hallazgos en la ecocardiografía bidimensional, observando el septum
posterobasal que no está afectado en la MCH, las características
de la hipertrofia, los hallazgos en modo M (características de la
válvula aórtica y el SAM) y con la utilización del
Doppler pulsado con PRF alta y Doppler color para localizar con exactitud
el sitio de la obstrucción.
Por otra parte la coexistencia
de obstrucción subaórtica dinámica está bien
reconocida en las obstrucciones fijas del TSVI y en patologías como
transposición de grandes vasos. También el Doppler pulsado
con PRF alta permite diferenciar las velocidades de cada sitio de obstrucción.
Otros métodos de diagnóstico.
Generalmente la ecocardiografía
proporciona todos los datos necesarios para el manejo clínico de
los pacientes con MCH. Cuando los hallazgos clínicos y ecocardiográficos
no se correlacionan, el cateterismo cardíaco puede ser de ayuda.
La coronariografía puede poner de manifiesto una coronariopatía
obstructiva concomitante. También puede observarse la obstrucción
dinámica de reposo, que aumenta o bien que se pone en evidencia
con maniobras de provocación. Además se observa una alteración
de la distensibilidad ventricular, con una presión de fin de diástole
elevada. Cerca del 25% de los pacientes presentan hipertensión pulmonar,
por lo general es leve, pero a veces puede ser moderada a severa. En los
pacientes que presentan obstrucción del TSVI puede evidenciarse
en un 15% gradiente de presión en el tracto de salida del ventrículo
derecho.
Evolución natural
La evolución
es variable, generalmente con deterioro clínico lento. En un 10-15%
evolucionan a una miocardiopatía dilatada. Cabe recordar que una
ecocardiografía normal en un niño o adolescente no excluye
el diagnóstico de MCH, puesto que puede hacerse evidente en forma
más tardía (4). La mortalidad de esta patología es
de 1-5% anual, la sobrevida a 5 años es de 90% y a 10 años
de 85%.
Los signos de mal pronóstico,
que identifica a un grupo con mayor riesgo de MS, son: edad joven (<30
años), síncope en niños, antecedentes familiares de
muerte súbita, genotipo adverso y taquicardia supraventricular o
ventricular sostenida. La presencia o gravedad de un gradiente en el TSVI
y el grado de limitación funcional no se relacionan con el riesgo
de MS. La taquicardia ventricular no sostenida en Holter de 48 hs. tiene
un valor predictivo negativo de MS mayor del 90%. La hipotensión
inducida con el ejercicio tiene un valor predictivo negativo de MS del
95% en pacientes menores de 50 años (1). La MCH de pacientes mayores
o ancianos usualmente tienen una evolución benigna y la ergometría
para evaluar el comportamiento de la presión arterial en este grupo
de pacientes tiene poca relevancia pronóstica.
Tratamiento
Los objetivos del tratamiento
son el alivio de los síntomas, la prevención de las complicaciones
y la reducción del riesgo de MS.
El tratamiento farmacológico
consiste en la utilización de betabloqueantes, antagonistas de calcio,
y disopiramida.
Los betabloqueantes
son los principales fármacos en el tratamiento médico. Su
uso alivia la disnea, la angina y el presíncope. El antagonista
de calcio mas utilizado es el verapamilo, que por su efecto inotrópico
negativo disminuye el gradiente del TSVI y mejora el llenado ventricular.
En cuanto a la disopiramida
también ha sido utilizada en la MCH por su capacidad para disminuir
la contractilidad miocárdica y así la obstrucción
del TSVI. La digoxina no se recomienda porque puede incrementar el gradiente
del TSVI.
Si ha habido fibrilación
ventricular o MS recuperada, se recomienda el implante de un desfibrilador
automático (5). Si existe taquicardia ventricular sostenida muchos
autores también indican el desfibrilador automático, pero
otros prefieren ensayar con amiodarona y controlar la respuesta con Holter
de 48 hs y/o estudio electrofisiológico. En los pacientes con taquicardia
ventricular no sostenida se utiliza la amiodarona.
El implante de un marcapaso
bicameral (DDD) en un paciente con MCH obstructiva puede reducir el gradiente
subaórtico (7). El beneficio hoy en día es discutido. En
algunos centros se utiliza en pacientes muy sintomáticos que no
responden al tratamiento farmacológico y en los que el tratamiento
quirúrgico implica un elevado riesgo.
La miotomía-miectomía
quirúrgica de la porción del septum que produce la estenosis
subaórtica ha sido empleada con cierto éxito. Está
indicada en los pacientes muy sintomáticos, con un gradiente del
TSVI mayor de 50 mmHg y que no responden a otras medidas terapéuticas.
Una alternativa no quirúrgica que puede ser eficaz , aunque tiene
un uso limitado, es la inducción de un infarto localizado en la
porción subaórtica del septum interventricular, con la infusión
de alcohol en la correspondiente arteria septal (2). Por último
en pacientes con clase funcional NYHA III-IV en fase dilatada que no responden
a las medidas terapéuticas comentadas puede estar indicado el trasplante
cardíaco.
Conclusión
La ecocardiografía
es el método de elección para el diagnóstico de la
MCH.
Como se trata de un
desorden genético debe ser realizada a todos los familiares de primer
orden del paciente afectado.
El diagnóstico
de esta patología puede disminuir el riesgo de MS con un tratamiento
adecuado.
El amplio rango de
hallazgos ecocardiográficos debería plantear al clínico
la sospecha de afectación genética incluso en personas sin
manifestaciones ecocardiográficas clásicas. Los pacientes
con afectación genética, sin manifestaciones ecocardiográficas
pueden tener riesgo de arritmias y MS.
BIBLIOGRAFIA
1- Olivotto I, Maron
BJ, Montereggi A et al. Prognostic value of systemic blood pressure response
during excercise in a community-based patient population with hypertrophic
cardiomyopathy. J Am Coll Cardiol 1999; 33:2044-51.
2- Seggewiss H, Gleichmann
U, Faber L et al. Ablacion transluminal percutanea del septo miocárdico
en la miocardiopatia hipertrofica obstructiva: resultados agudos y seguimiento
a los 3 meses en 25 pacientes. J Am Coll Cardiol 1998;31:252-258.
3- Maron BJ, Isner J, McKenna
WJ. Task force 3: cardiomyopathy, miocarditis and other myopericardial
diseases and mitral valve prolapse. J Am Coll Cardiol 1994; 24:845-899.
4- Solomon SD, Simonetta
W, Watkins H et al. Hipertrofia y morfologia del ventriculo izquierdo en
la miocardiopatia hipertofica familiar asociada a mutaciones del gen de
la cadena pesada de la betamiosina. J Am Coll Cardiol 1993; 22:498-505.
5- Primo J, Geelen P, Brugada
J et al. Miocardiopatia hipertrofica: papel del desfibrilador automatico
implantable. J Am Coll Cardiol 1998;31:1081-1085.
6- Otto CM. Textbook of
clinical echocardiography. 2nded. Philadel- phia: WB Saunders,
2000: 188-196.
7- Fananapazir L, Mc Reavy
D. Opciones terapeuticas en pacientes con miocardiopatia hipertrofica obstructiva
y síntomas graves refractarios a fármacos. J Am Coll Cardiol
1998; 31:163-167.
Ir
al Indice General
Ir a la Tapa de la Revista
Volver a la página
de la Facultad





