Revista de Posgrado de la
Cátedra VIa Medicina N° 110 -Noviembre/2001
Página: 1-7
OSTEOPOROSIS
– 1ª PARTE
Prof. Dr. Víctor José
Villanueva
A fin de poder comprender todo lo concerniente a esta enfermedad dividiremos
nuestra publicación en dos partes. La primera, se ocupará
de los aspectos básicos de estructura, bioquímica, función
y dinámica del hueso normal. La segunda, a publicarse en el próximo
número de la revista de la carrera, tratará sobre el síndrome
osteoporótico.
Aspectos
estructurales, bioquímicos y funcionales de los huesos:
El tejido óseo, en cuyo ámbito se desarrolla la osteoporosis,
está compuesto por tres elementos: a) las células- b) la
matriz orgánica y c) la matriz mineral.
a)
Células: las células propias del tejido óseo son
los osteoblastos, los osteocitos y los osteoclastos. Los osteoblastos son
derivados de las células mesenquimatosas remanentes en el tejido
conjuntivo de la médula ósea, periostio y endostio que recubren
por dentro y por fuera a los huesos. Son células que se encargan
de producir la sustancia fundamental y las fibras colágenas de la
matriz orgánica las cuales rodean la célula que de este modo
queda encerrado en una cavidad que comunica con otros similares. Una vez
rodeado por sus productos de secreción y vuelto a una situación
de inactividad sufre cambios que lo transforman en osteocito. El conjunto
de osteoblasto, osteocito y matriz orgánica aún no mineralizada
se denomina osteoide. El proceso subsiguiente de depósito
de cristales de fosfato tricálcico, mineraliza el osteoide y lo
transforma en hueso. Las cavidades y ramificaciones que alojan los
osteocitos y sus prolongaciones comunican entre si y con los espacios extracelulares
de las estructuras vecinas (médula ósea, endostio y periostio)
con lo que se asegura el intercambio de diversas sustancias entre el hueso
y el espacio intersticial y el intravascular. Los osteoblastos, en especial
en períodos de actividad, sintetizan gran cantidad de fosfatasa
alcalina con pasaje al espacio intercelular y de allí, una parte
a la sangre, con lo que su medición aporta un dato sobre la osteogénesis.
Los osteoclastos son células gigantes, multinucleadas, derivadas
de monocitos de la sangre o de macrófagos de la médula ósea.
Su función es la destrucción del hueso por medio de la disolución
de las sales inorgánicas y la hidrólisis de las proteinas
de la sustancia intersticial.
b)
Matriz orgánica: forma parte de la sustancia fundamental. Está
formada en más del 90 % por fibras colágenas que comunican
al hueso su resistencia a la tracción. Cada fibra colágena
está constituida por filamentos de tropocolágena que son
cadenas de tres unidades de polipéptidos enrolladas en forma de
hélice. En ellas existe el aminoácido hidroxiprolina que
es liberado por hidrólisis y excretado por la orina cuando se reabsorbe
hueso y esto hace que la medición de la hidroxiprolinuria sea un
marcador de destrucción ósea. Menos del 10% de la sustancia
fundamental es amorfa y anhista (no se dispone en ninguna forma de estructura)
está compuesta por diversas proteínas, algunas derivadas
de la sangre (albúmina, alfa glucoproteinas) y otras, como la osteocalcina
producida por los osteoblastos que en pequeñas cantidades pasa a
la sangre y su medición resulta un buen índice de la formación
de tejido óseo.
c)
Matriz mineral: el depósito de fosfato tricálcico, en
forma de cristales (hidroxiapatita) así como de otros minerales
como carbonato, sodio y magnesio se verifica en el componente amorfo de
la sustancia intercelular pero siguiendo la orientación y en la
cercanía de las fibras colágenas. Todos estos minerales,
que constituyen el 99 % de la sustancia intercelular del tejido óseo,
aportan la dureza y rigidez características del hueso necesarias
para su función de sostén. Además su contenido cálcico
le permite actuar como liberador del mismo cuando desciende la calcemia
y así, regular la función neuromuscular, la coagulabilidad
de la sangre y otras más. Lo mismo sucede con el magnesio. Gracias
al bicarbonato y al fosfato actúa como regulador del pH del medio
interno. Además, aporta el fosfato necesario para producir los compuestos
que almacenan o liberan energía dentro de las células (ATP-
ADP- AMP cíclico).
Organización
del tejido óseo para formar huesos:
Los tres elementos del tejido óseo se organizan para constituir
dos tipos diferentes de hueso:
Compacto o Cortical
Hueso
Trabecular o esponjoso
Hueso
compacto: es el que predomina en el esqueleto(85 % ). Se encuentra
constituyendo la diáfisis o cuerpo de los huesos largos(miembros
superiores e inferiores) y las cubiertas externa e interna, o tablas, de
los huesos planos(bóveda del cráneo, esternón, costillas)
y la envoltura exterior de las vértebras. Los diferentes elementos
del tejido óseo forman láminas curvadas, apuestas y soldadas
paralela y sucesivamente constituyendo tubos concéntricos, en número
de alrededor de diez, rodeando un conducto central(conducto de Havers).
En este conducto, de posición vertical, como las láminas
paralelas, existe vasos sanguíneos y linfáticos, nervios
y médula ósea y su luz comunica con las prolongaciones de
las cavidades donde se alojan los osteocitos, y a través de éstas
con el espacio intersticial. Para perfeccionar el sistema, existe conductos
de dirección horizontal y oblicua que comunican los conductos verticales
o de Havers, llamados conductos de Volkmann. En su interior existe el mismo
contenido. El conjunto de todas estas estructuras recibe el nombre de osteón
o
sistema de Havers. El hueso compacto de las diáfisis rodea un conducto
central, el canal medular donde se encuentra médula ósea,
vasos y nervios. Comunica con los conductos de Havers y de Volkmann.
Hueso
trabecular: (15 % del esqueleto adulto), constituye la mayor parte
los huesos planos y cortos, donde recibe el nombre de díploe. También
se lo encuentra en las extremidades o epífisis de los huesos largos.
El tejido óseo se estructura en forma de trabéculas de variada
dirección que se entrecruzan con otras constituyendo redes en cuyas
espacios existe médula ósea, vasos y nervios. El conjunto
semeja una esponja. Como cada trabécula aporta superficies de intercambio
con la médula ósea, superior a la superficie que proviene
del hueso cortical, en total, constituye la porción donde se verifica
los fenómenos metabólicos de remodelación y recambio
con mayor intensidad.
A fin de ilustrar lo anteriormente expuesto presentamos las figuras Nº
50- 51 y 53 al final de este escrito.
Dinámica
de los huesos:
Para poder cumplir con su función metabólica y evitar las
alteraciones por fatiga derivadas de la función de sostén
(micro fracturas de las laminillas del hueso compacto o de las trabéculas
del hueso esponjoso), los huesos sufren cambios que lo renuevan durante
toda la vida. Estos cambios reciben, en conjunto, el nombre de remodelación
ósea y consisten en el reemplazo de osteonas y trabéculas
maduras o viejas por otras nuevas que se disponen en la misma forma repitiendo
igual estructura que antes de la remodelación. Es decir que los
huesos no cambian de forma ni tamaño a pesar de destruir y formar
tejido propio permanentemente. La remodelación es un proceso localizado
y secuencial que se instala uni o polifocalmente(en puntos determinados,
en determinados huesos, y en un momento determinado) y se inicia cuando
en el foco (general-mente en las superficies de intercambio ) aparecen
osteoclastos. Su actividad osteolítica labra una cavidad (llamada
Laguna de Howship) en forma de túnel de varios micrones de profundidad
y pocos de ancho en el hueso compacto mientras que en las trabéculas
del hueso esponjoso es de poca profundidad y gran anchura. Luego son desalojados
o mueren. El fondo y paredes de la laguna son, entonces, tapizados por
osteoblastos que proliferan y depositan osteoide que luego se va calcificando.
Al cabo, una porción de hueso joven reemplaza al viejo(ver figura
21-2 ). La zona que ha sufrido estos cambios y los elementos que intervienen
constituyen la unidad de remodelación ósea. Este proceso
coordinado de destrucción ósea seguido de otro de formación
en el mismo sitio se llama acoplamiento. El volumen de tejido óseo
renovado en un tiempo determinado se denomina recambio o " turn over "
y depende de la rapidez de la acción de osteoclastos u osteoblastos
o del número de unidades de remodelación en actividad en
ese periodo. El recambio es mayor en el hueso esponjoso que en el cortical
por ofrecer mayor superficie de intercambio con el líquido extracelular
y quedar más expuesto a factores que lo estimulan como algunas hormonas.
Se llama balance óseo a la diferencia entre el hueso destruido y
el formado en cada unidad de remodelación. El mismo puede ser neutro,
negativo o positivo según que ambos sean equivalentes, predomine
el primero o el segundo. Cuando al balance negativo se le agrega un recambio
acelerado, se agrava la osteopenia(pérdida de hueso).
Evolución
de la masa ósea con la edad:
El balance óseo es positivo desde el nacimiento hasta la juventud.
Se vuelve neutro en la adultez y resulta negativo en la vejez. Al máximo
de masa ósea se llega entre los 20 y 40 años y a partir de
esa edad el balance se vuelve negativo perdiéndose alrededor del
0,6 al 0,7 % de la masa del esqueleto por año. En la mujer, a partir
de la menopausia, se acelera la pérdida ósea en un monto
de alrededor del 3% por año por aumento del recambio y aumento de
la acción osteoclástica. Esta aceleración dura entre
5 y 10 años en los cuales ella ha perdido entre un 15 y un 30% adicionales
de su esqueleto y desde entonces vuelve al 0,7 % anterior. Estas circunstancias
hacen que la osteoporosis sea, generalmente, una enfermedad de la vejez,
y aparezca más precozmente y sea más grave en la mujer.
Regulación
de la remodelación y del recambio óseo
Existe dos clases de factores que influyen en el remodelado y recambio
de los huesos. Según su origen se clasifican en locales y generales.
Factores
generales: son las siguientes hormonas: paratiroidea, calcitonina,
calcitriol, estrógenos, glucocorticoides, somatotrofina, hormonas
tiroideas e insulina.
Factores
locales: producidos localmente en los huesos son las citoquinas, factores
de crecimiento y prostaglandinas. Un factor local, de naturaleza mecánica,
la carga o peso que soporta el hueso durante el movimiento produce un efecto
piezoeléctrico en la hidroxiapatita(al rozarce los cristales generan
corriente eléctrica) que estimula la función osteoblástica.
Veamos como funcionan los diferentes reguladores:
Factores
generales
Hormona
paratiroidea: es una proteina producida por las células principales
de las glándulas paratiroides dependiendo su síntesis y liberación
de la calcemia. Cuando ésta baja a menos de 8 mg % aumenta su liberación
primero y su síntesis después. Si la calcemia sobrepasa los
10 mg % cesa su producción. El efecto de la hormona es el de aumentar
la calcemia y lo hace actuando a dos niveles en forma directa y una en
forma indirecta. En forma directa actúa: a) sobre los osteoclastos
aumentando su actividad, su tamaño y su número. A través
de la remoción del tejido óseo hay liberación de calcio
y fósforo que pasan a la sangre. b) Sobre el tubo contorneado distal
de la nefrona induce un aumento de la reabsorción del calcio del
fluido tubular con aumento de la excreción de fosfato y de sodio.
En forma indirecta, induce la actividad de la hidroxilasa de los túbulos
renales con lo que se incrementa la formación de calcitriol o 1-
25 dihidroxi vitamina D cuyo efecto es el aumento de la absorción
intestinal del calcio de los alimentos.
Calcitonina:
se produce en las células parafoliculares de la tiroides y se libera
en respuesta al tenor de la calcemia pero en forma inversa a la parathormona.
Cuando la calcemia supera los 10 mg % se libera y cuando ésta es
menor que 8 mg.% se inhibe su secreción. También la estimulan
el glucagon y las hormonas digestivas secretina, gastrina, colecistokinina
y pankreozimina. Es una hormona de efecto hipocalcemiante a través
de la inhibición de la acción y de la población de
los osteoclastos. Además, inhibe la reabsorción tubular del
calcio, sodio y fosfato.
Vitamina
D: la vitamina D es una prohormona inactiva sobre el metabolismo del
calcio que debe transformarse en vitamina D3 o calcitriol a nivel renal.
Hay dos fuentes de la vitamina. Una, exógena, corresponde al ergosterol
de los siguientes alimentos: leche, huevos, margarina y pescado. La otra
fuente, endógena, proviene de la transformación del 7- dehidro
colesterol en la epidermis por efecto de los rayos ultravioletas de la
luz solar. Cualquiera sea su origen, estos compuestos pasan a la sangre
y en los hepatocitos son hidroxilados por la enzima hidroxilasa para generar
un compuesto con cierto efecto hormonal, el 24-hidroxicolecalciferol o
hidroxivitamina D. Este compuesto es nuevamente hidroxilado enzimaticamente
en los tubos contorneados originando el 1-25-hidroxicole-calciferol o calcitriol,
forma activa de la vitamina que actualmente se considera como una hormona
de origen renal. El principal sitio de acción del calcitriol es
a nivel intestinal donde promueve la absorción del calcio y del
fosfato. Sobre el hueso actua en forma sinérgica con la parathormona
estimulando la reabsorción. Se piensa que lo hace a traves del estímulo
de la transformación de células precursoras a osteoclastos.
Sobre el riñón induce aumento de la reabsorción tubular
de calcio y fosfato. Sobre las paratiroides, inhiben la secreción
hormonal.
Hormonas
tiroideas: en forma indirecta, posiblemente a través de la somatomedina
estimula el crecimiento y la maduración ósea pero a nivel
óseo, a través de mediadores locales, estimula los osteoclastos
y promueve aumento del recambio y de la reabsorción ósea.
El cortisol y similares tiene un marcado efecto promotor de los osteoclastos
e inhibor de los osteoblastos. Sobre el metabolismo mineral, reducen la
síntesis renal de calcitriol y por ello la absorción intestinal
de calcio y fósforo y a nivel renal aumentan la excreción
del calcio. Estos efectos, a través de la hipocalcemia inducen una
exagerada descarga de hormona paratiroidea.
Esteroides
sexuales: los estrógenos, más intensamente que los andrógenos,
tienen un efecto supresor sobre la reabsorción ósea. No se
sabe si se trata de efectos directos o por intermediarios de acción
local en los huesos.
La
insulina actúa directamente estimulando los osteoblastos e indirectamente
sobre el hígado promoviendo la liberación de somatomedina
La
somatotrofina tiene efecto anabolizante, positivo sobre la formación
ósea y actúa a través de la somatomedina C y el factor
tisular de crecimiento similar a la insulilna.
Factores
locales que influyen en la remodelación ósea:
Existe en los huesos diversas sustancias, algunas generadas localmente
por células propias y otras generadas por elementos provenientes
de la sangre que liberarían sus productos en el tejido óseo.
Estos elementos actuarían sobre los osteoblastos o los osteoclastos
induciendo su proliferación, diferenciación y actividad secretora
o lítica. Los más conocidos son: 1) Factor de crecimiento
epidérmico, Factores 2) alfa y 3) beta transformadores del crecimiento,
4) Factor de crecimiento derivado de las plaquetas, 5) Factor de crecimiento
esquelético. De ellos, el nº1 y 2 estimulan los osteoclastos
y producen balance óseo negativo.El nº 3 y el nº 5 activan
los osteoblastos y positivizan el balance. Algunas linfoquinas como el
factor activador de los osteoclastos aumentan la reabsorción ósea.
La prostaglandina E2 tiene el mismo efecto mientras que el interferón
gamma tiene efecto opuesto. Además, se postula que la misma actividad
osteoblástica liberaría diversos factores de reabsorción
que estimularían los osteoclastos; viceversa, la actividad osteoclástica
produciría factores estimulantes de los osteoblastos. (Para ilustración
veáse la figura 21-4).
Marcadores
biológicos de la remodelación ósea:
Son compuestos o enzimas producidos directamente por las células
activas o bien, derivadas de su actividad sobre el substrato óseo.
También la medición de las diferentes hormonas que intervienen
en el metabolismo óseo es útil para conocer su estado.
Veamos los más importantes:
Fosfatasa
alcalina: es producida por los osteoblastos pero en la sangre existe
una proporción de la enzima que no proviene del hueso sino del hígado,
intestino y placenta de modo que nivel no es un índice fiel de la
función osteogénica. Se estima que alrededor del 50 % de
la enzima en sangre proviene del esqueleto y el otro 50 % se reparte entre
hígado e intestinos. Sus valores normales son diferentes de acuerdo
al método de medición utilizado. Aumenta fisiológicamente
durante la infancia y la adolescencia, cuando hay intensa formación
de tejido óseo. Un método actual de dosaje expresa los resultados
en unidades por ml de sangre y el valor normal oscila entre 40 y 190 mU
/ ml. Cuando se desea investigar su origen hepático se debe pedir
alguna determinación que sea propia del hígado o no exista
en el hueso como la 5- nucleotidasa o la gamma glutamil transpeptidasa.
Su correlación con la clínica y otros marcadores óseos
puede dilucidar, también, el problema
Fosfatasa
ácida tartrato resistente: proviene de los osteoclastos. Se
puede conocer su valor midiendo la fosfatasa ácida total y la prostática
y restando la segunda de la primera. Es un marcador de destrucción
ósea. El valor de la fosfatasa ácida total en sangre es menor
de 11 mU / ml. y el de la prostática menor a 4 de modo que la tartrato
resistente no debe pasar de 7 mU / ml. Su aumento indica aumento de la
reabsorción ósea.
Hidroxiprolina
urinaria: es un aminoácido que forma parte de la proteína
de las fibras colágenas y que se libera cuando se destruye la matriz
orgánica del hueso y sus proteínas hidrolizadas. Llegada
con la sangre al riñón, es excretada. Su excreción
normal en 24 hs. es de 15 a 40 mg. Su aumento indica destrucción
de hueso. La gelatina es un alimento rico en este aminoácido de
modo que cuando se quiera medirlo se debe prescindir de su ingesta varios
días antes.
Osteocalcina:
Es una proteina secretada por los osteoblastos y forma parte de la sustancia
instersticial, no fibrilar, del tejido óseo, pequeñas cantidades
de la misma pasan a la sangre de modo que su aumento indica intensa regeneración
del mismo Sus valores normales oscilan entre 3 y 15 ng./ dl.
Calcemia:
Este
ión se encuentra en tres formas en el plasma. Una es la forma ligada
a las proteinas plasmáticas, en especial la albúmina (45
% del total). Otra es el calcio libre, en estado iónico (47 % )
que es el que atraviesa las membranas de los compartimientos orgánicos
y ejerce sus acciones biológicas. Un 8 % del calcio se encuentra
en forma de complejos unido al fosfato. La calcemia total es de 8, 5 a
10, 5 mg. %. La fracción ionizada es de 4,1 a 4,8 mg. %. Dado la
alta proporción de calcio unido a la albúmina sanguínea,
una variación de ésta puede simular una alteración
de la calcemia total o la iónica de modo que para darle su justo
valor se debe determinar también la albuminemia. Si ella es mayor
que 4 g %, se debe restar 0, 8 de la calcemia por cada gramo de albúminemia
que sobrepasa este límite. Si la albuminemia es menor que 4 g %
se debe sumar el índice 0, 8 al valor de la calcemia. Para conocer
el valor de la fracción iónica, si no se la puede medir,
se debe obtenerla a partir de la calcemia total teniendo en cuenta que
aquella representa el 47 % del total. La calcemia iónica depende
también del pH de la sangre, la acidosis la aumenta y la alcalosis
la disminuye. A grosso modo, recordemos que cuando existe destrucción
ósea hay liberación de calcio y pasaje del mismo a la sangre.
Este efecto es remedado por la hormona paratiroidea. Cuando hay formación
de tejido óseo o efecto inhidor de los osteoclastos, hay captación
de calcio desde la sangre con la consiguiente hipocalcemia. Este efecto
es reproducido por la calcitonina o los fosfonatos usados en terapéutica.
Otro factor que regula la calcemia es la absorción intestinal. Así,
en presencia de un síndrome de mala absorción, habrá
hipocalcemia.
Calciuria:
la excreción del calcio por la orina es un parámetro menos
fiel que la calcemia para conocer el estado óseo y porque el organismo
utiliza el aparato urinario, junto con el digestivo para manejar el calcio
y mantener los valores en sangre dentro de límites muy estrechos.
Depende de la ingesta diaria de calcio con la dieta y con una dieta libre
y habitual puede llegar a un máximo de 300 mg. en 24 hs. y con una
restricción dietética (especialmente lácteos) desciende
hasta 180 mg. La mujer, por tener menor masa ósea que el hombre
tiene una calciuria inferior, alrededor de 250 mg. por día. Otra
forma de evaluar la calciuria es relacionándola con el peso corporal
siendo lo normal la excreción urinaria de 4 mg. de calcio por kg.
de peso y por día. Este método de análisis es engorroso
porque exige la recolección escrupulosa de orina de 24 hs. y sujeta
a causar error. Para subsanar el inconveniente se puede medir directamente
las cifras de calcio y de creatinina en la orina y determinar el cociente
calcio % creatinina cuyo valor normal es para el máximo de 0, 21
mg, y para el mínimo, de 0, 07 mg. Hay que tener en cuenta que el
sodio arrastra el calcio en la excreción renal de modo que un exceso
de sodio en la dieta puede aumentar la calciuria. Por otra parte, los diuréticos
no tiazídicos como la furosemida estimulan la diuresis cálcica
mientras que las tiazidas la inhiben. Estos efectos explican porque se
usa hidroclorotiazida en la litiasis urinaria (inhibición de la
excreción del calcio por el riñón para impedir la
precipitación en sus túbulos y la formación de cálculos)
o el cloruro de sodio y la furosemida en las hipercalcemias (estimulan
la excreción renal y de esa manera bajan la calcemia).
Fosfatemia:
Los
fosfatos de la sangre se encuentran en dos formas, sales inorgánicas
(de sodio, potasio y calcio) y compuestos orgánicos. Los que se
dosan son las sales inorgánicas y su valor oscila entre 2, 5 y 4,
5 mg. %. Sus valores pueden variar por múltiples circunstancias,
independientemente de la patología ósea como por ejemplo
la ingesta diaria, ayuno, vómitos, la función renal, los
hidratos de carbono de la dieta (su riqueza baja la fosfatemia). Con la
calcemia, la fosfaturia y la hidroxiprolinuria constituye un buen conjunto,
índice de la función paratiroidea.
Fosfaturia:
sus valores normales son muy variables dependiendo de la ingesta, la función
renal y otros factores. Se utiliza cuando se desea estudiar las osteopatías
renales utilizando otros índices más sensibles que una fosfaturia
aislada como por ejemplo el clearance de fosfato. Recordar que el efecto
principal de la parathohormona sobre los fosfatos es aumentar su excreción.
El valor de la fosfaturia diaria oscila entre 400 y 1.200 mg.
Dosajes
hormonales: se suele determinar los valores en plasma sanguíneo
de parathormona, calcitonina y 24 hidroxicolecalciferol (es el metabolito
resultante de la transformación en el hígado de la provitamina
D endógena y exógena). Estos análisis son muy costosos
de efectuar porque requieren una metodología compleja de manera
que no se los debe pedir como rutina sino después que otros análisis,
la clínica y / u otro método lleven a la sospecha de que
su secreción esté alterada. La medición por R.I.E.
de los fragmentos carboxiterminal y medio molecular de la cadena peptídica
de la parathormona arroja un valor normal de 20 a 100 pg. x ml. Se la utiliza
cuando se sospecha hiper o hipoparatiroidismo y junto con su determinación
hay que pedir una calcemia y una creatininemia para diferenciar un problema
primario de uno secundario de la glándula. La medición de
la concentración plasmática de la calcitonina se suele pedir
para el diagnóstico del carcinoma medular de la tiroides pues tiene
poco valor en el estudio de las osteopatías metabólicas.
Lo mismo para la vitamina D. La determinación del 25 hidroxicolecalciferol
es útil es para el estudio de osteopatías en el raquitismo,
síndrome de mala absorción y hepatopatías crónicas.
La determinación de la concentración de 1- 25 dihidrocolecalciferol
sirve para el diagnóstico de las hipercalcemias en las enfermedades
granulomatosas (sarcoidosis, TBC, micosis profundas) y linfomas. También
es útil para la osteopatía metabólica de la insuficiencia
renal crónica (valores bajos).
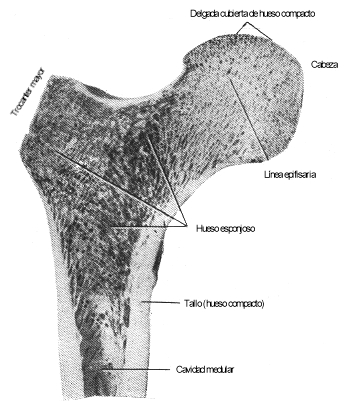
Sección longitudinal a través
del extremo superior de un fémur de adulto. La línea epifisaria
del gran trocánter no es evidente
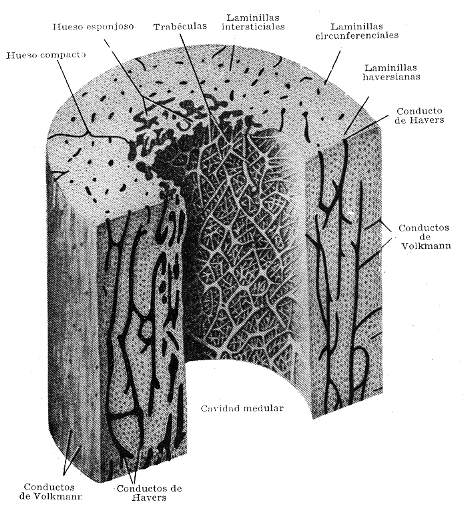
Diáfisis del húmero.
Dibujo efectuado de un hueso macerado (no descalcificado). (De H. Poll.)
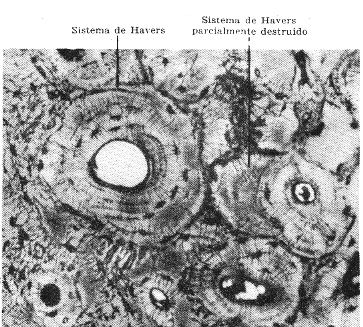
Sección transversal a través
de la diáfisis del fémur de un mono rhesus adulto joven.
Sección descalcificada de 6m
. Las paredes de las lagunas, de los canalículos y de los canales
de Havers tomaron el colorante. (Método de la tirosina-ácidofosfomolíbdico
de Schmor.. Fotomicrografía x 220).
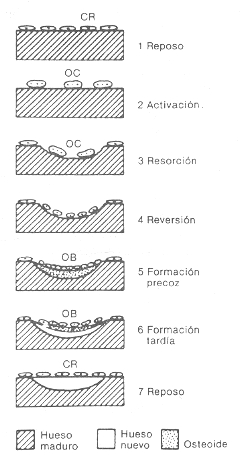
Diagrama del proceso de remodelamiento
óseo normal. Se puede observar lo que ocurre a nivel de una unidad
simple de remodelamiento (Modificado de AM Parfigg. Med. Times 109:80,
1981)
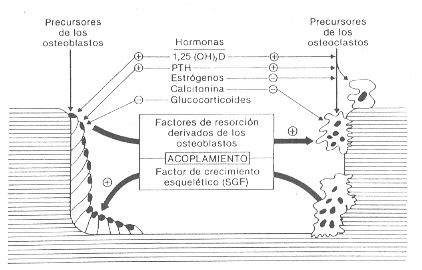
Remodelamiento óseo y su regulación.
Posible rol de algunas hormonas que tendrían mayor importancia en
la misma. (Modificado de Haussler y colaboradores. En : Psteopososis. C
Christiansen CD Arnaud, BEC Nordin, AM Parfitt, WA Peck, BL Riggs (Eds)
Copenhague, 1984, p:729).
BIBLIOGRAFIA
-
Smith P E, Copenhaver W M. Los tejidos
conjuntivos: cartílago y hueso. En: Bailey F, ed. Histología.
3º edición en Español. Buenos Aires: López Libreros,
1960: 127 - 158.
-
Vega E, Mautalen C. Fisiopatología
del metabolismo mineral y esquelético. Laboratorio, En: Maccagno
A ed. Reumatología. Buenos Aires: Librería El Ateneo Editorial,
1991: 252 - 262.
-
Gonzáles Macías J y col.
Enfermedades óseas. En: Farreras Rozman, ed. Medicina Interna.13º
edición. Madrid: Mosby Doyma Libros, 1995: vol 1: 1064 – 1068.
Ir
al Indice General Ir
a la Tapa de la Revista
Volver a la página de la Facultad




