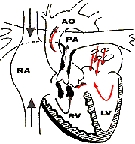
Figura 1 . Anatomía de la tetralogía de Fallot.
Tomado de: Hospital de Winsconsin.http://pedsccm.wustl.edu/All-Net/english/cardpage/operate/TOF/diaTOF-2.html
TRATAMIENTO QUIRURGICO DE LA TETRALOGIA DE FALLOT CLASICA: REVISION BIBLIOGRAFICA
Marcelo Maximiliano Avila, Gustavo Lorenzo Escalada Lesme, Maria Angelina Martínez, Patricia Natalia Melnechuk, Mirta Liliana Miérez
Alumnos de 6º curso de la carrera de medicina. Cátedra VI de Medicina. Facultad de Medicina.
Universidad Nacional del Nordeste. Corrientes, Argentina.
E-mail: patriciamelnechuk@uolmail.com
Prof. Dr. Raúl O. Cayré
En 1888, Arthur Fallot, publicó sus observaciones clínicas considerando los cuatro elementos constituyentes de una cardiopatía a la que llamó" la maladie bleue" y que posteriormente, se denominó tetralogía de Fallot (TOF) a saber: defecto ventricular septal, estenosis infundibular pulmonar, dextroposición de la aorta e hipertrofia ventricular derecha (1). Desde el punto fisiopatológico, las características dominantes de la TOF son: el defecto ventricular septal y el grado de obstrucción del tracto de salida del ventrículo derecho (TSVD) (Fig.1).
La primera intervención quirúrgica de la TOF fue realizad a por Blalock y Taussig en 1945; la cual consistió en una cirugía paliativa efectuando un cortocircuito (shunt) entre la arteria subclavia a la rama derecha de la arteria pulmonar (2). Dicha cirugía paliativa, experimentó subsecuentemente modificaciones que progresivamente, enriquecieron este campo de la cirugía cardíaca (3-8).
Simultáneamente en 1948, Sellors (9) y Brock (10) publican la apertura quirúrgica o valvulotomía de la válvula pulmonar y del tracto de salida del ventrículo derecho o infundibulotomía.
En 195 Lillehei realiza con éxito la primera corrección completa de la TOF, clausurando el defecto ventricular septal y liberando la obstrucción del TSVD con un soporte circulatorio entre padre y niño (11). La utilización de una máquina corazón pulmón por Kirklin y col. En 1955 (12) y posteriormente la introducción del método de Kyoto de hipotermia profunda y paro circulatorio (13), permitieron la serie de modificaciones a la corrección completa de la TOF, que cambiaron sustancialmente los resultados quirúrgicos, creando un antes y un después en este tipo de cirugía.

Figura 1 . Anatomía de la tetralogía de Fallot.
Tomado de: Hospital de Winsconsin.http://pedsccm.wustl.edu/All-Net/english/cardpage/operate/TOF/diaTOF-2.html
Desarrollo
Es de suma importancia que el cirujano tenga una imagen clara de la anatomía del paciente, la cual se obtiene por medio de la ecocardiografía y del cateterismo cardiaco (14).
El estudio ecocardiográfico de la tetralogía de Fallot debe comprender un análisis de:
- Tamaño adecuado del ventrículo izquierdo.
- Ausencia de lesiones asociadas severas.
- Lesiones asociadas severas que aumentan el riesgo de la corrección total:
INDICACION
Y CLASIFICACION QUIRURGICA
La indicación
quirúrgica debe contemplar los aspectos clínicos, la edad
del paciente y las características anatómicas. Algunos grupos
quirúrgicos
(16)
utilizan una clasificación basada
en el agrupamiento de las características anatómicas afines
y de acuerdo a la dificultad técnica, riesgo quirúrgico inmediato
y pronóstico futuro.
Grupo I: casos con anatomía desfavorable para la corrección completa. Se efectúa cirugía paliativa (enfermos sintomáticos o edad inadecuada para la corrección completa).
Factor anatómico:
contraindicación absoluta.
Factor edad: contraindicación
relativa.
Grupo II: casos con anatomía favorable para la cirugía correctora. En este grupo se incluyen los diferentes tipos de Fallot que varían desde el Fallot leve hasta los casos extremos o muy severos (16).
Kirklin y Barrat-Boyes (17) consideran los siguientes parámetros anatómicos para la indicación quirúrgica:
Ø Tetralogía de Fallot con estenosis leve y asintomático: Son los pacientes que toleran bien la cardiopatía y la operación se pospone hasta los 4 años de edad.
Ø Tetralogía de Fallot con estenosis pulmonar: La corrección completa, e aconseja como procedimiento primario o después de una operación paliativa antes de los tres años de edad, para evitar complicaciones como policitemia severa, absceso cerebral y muerte, y para asegurar buenos resultados a largo término.
Comúnmente
los infantes con TOF con hipoxia y que requieren tratamiento dentro de
los tres primeros meses de vida, son tratados inicialmente con un shunt
clásico o con propanolol como tratamiento profiláctico para
las crisis hipoxémicas.
Cuando
un niño con TOF sin complicaciones, se encuentra en la necesidad
de tratamiento quirúrgico después de los tres meses de vida,
se aconseja la reparación primaria o definitiva. En casos en los
cuales se necesite parche transanular, es realizado un shunt con reparación
tardía, si el paciente es menor de 8 a 9 meses. Si existe un shunt
previo, la reparación definitiva se lleva a cabo a los 2 o 3 años
de edad.
Ø Tetralogía de Fallot con grados variables de hipoplasia de la arteria pulmonar: Cuando existe una hipoplasia severa de la arteria pulmonar, se realiza inicialmente un shunt. Estos pacientes son reevaluados al año o a los dos años; si tuvieron un incremento suficiente o adecuado en el tamaño de las arterias pulmonares, se realiza la reparación completa. Caso contrario, se efectua una cirugía paliativa definitiva con homoinjerto valvulado extracardiaco, que es colocado despues de los 5 años de edad y cerrando el shunt (17). En pocos pacientes es posible realizar una reparación del defecto ventricular septal posteriormente (Fig. 2).
Ø Tetralogía de Fallot con anomalías asociadas severas: Las anomalías asociadas , tales como, la ventana aortopulmonar, estenosis suboaórtica y la conexión anómala de las venas pulmonares, requieren ser reparadas tempranamente.
En casos de otras anomalías, como ser el defecto septal ventricular múltiple, la confección de un shunt da una buena paliación y la corrección definitiva, se efectúa a los dos o tres años de edad.
Ø Tetralogía de Fallot con estenosis pulmonar y origen anómalo de la arteria coronaria descendente anterior izquierda naciendo de la arteria coronaria derecha: La reparación primaria con un conducto valvulado extracardiaco entre el ventrículo derecho y la arteria pulmonar, es el tratamiento óptimo a cualquier edad. Cuando no hay acuerdo para la utilización de esta técnica en niños muy pequeños y los estudios preoperatorios, indican la posible necesidad de un parche transanular, se efectua un shunt y la reparación con conducto valvulado, se hace a los 5 a 10 años de edad. Cuando los estudios preoperatorios no indican el requerimiento de parches transanular ni infundibular, la reparación primaria es aconsejada en niños por encima de los 6 meses de vida (17).

Figura 2: Reparación del defecto ventricular septal. Incisión a través del TSVD
Tomado de: Hospital de Winsconsin. http://pedsccm.wustl.edu/All-Net/english/cardpage/operate/TOF/diaTOF-2.html
ABORDAJE
Cuando hay una estenosis infundibular aislada y particularmente si es leve, una ventriculotomía transversal o un acceso arterial derecho, son óptimos, pero se puede usar una ventriculotomía vertical. Cuando hay una hipoplasia difusa de la salida del VD o una estenosis valvular dominante con un anillo pequeño, es casi seguro que requiera un parche transanular (Fig. 3), e inicialmente es realizada una ventriculotomía vertical, limitada el infundíbulo.
Cuando hay una estenosis infundibular y valvular, puede realizarse una ventriculotomia transversal, ocasionalmente un acceso atrial derecho, pero una infundibulotomía vertical proporciona la máxima flexibilidad y es más conveniente para la extensión de la incisión a través del anillo para la colocación de un parche transanular dependiendo del diámetro del anillo. Cuando hay una estenosis infundibular, valvular y anular la probabilidad de la necesidad de un parche es grande, y una incisión vertical en el infundíbulo es realizada generalmente (17).
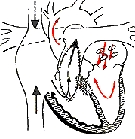
Figura 3: Reparación completa con parche transanular
Tomado de: Hospital de Winsconsin.http://pedsccm.wustl.edu/All-Net/english/cardpage/operate/TOF/diaTOF-2.html
INDICACIONES DE REOPERACION
La incidencia de reoperación por defectos residuales o recurrentes después de una reparación inicial intracardíaca es aproximadamente el 5%. El porcentaje de mortalidad en la reoperación es aproximadamente del 15%.
Las indicaciones más frecuentes de reoperación son: defecto ventricular septal residual y la obstrucción al TSVD residual o una combinación de ambos. La oxigenación de la sangre de la aurícula derecha debe ser comparada con la saturación de oxígeno de la sangre de la arteria pulmonar, si hay más del 10% de diferencia de la aurícula derecha a la arteria pulmonar, debe ser sospechado un defecto ventricular septal residual y reparado (18). Este defecto puede estudiarse electrocardiograficamente con vistas paraesternales de eje largo y corto, vista de cuatro cavidades apical y la vista subcostal de eje largo y corto. El Doppler color puede demostrar la dirección del shunt el cual es usualmente bidireccional. El mapeo de flujo ayuda también a identificar cualquier otro defecto presente desde la vista paraesternal de eje largo, el Doppler color puede ayudar en la posición de la onda continua o pulsátil para medir la velocidad a través del defecto, el cual usualmente es lento, debido a que ambos ventrículos tienen la misma presión.
La proyección o vista paraesternal eje largo con traductor inclinado permite visualizar el TSVD, la vista paraesternal eje corto de la base y la vista subcostal eje largo y corto desde la cual puede ser mejor vista el TSVD en su totalidad.
Estas vistas permiten la observación detallada del TSVD en su longitud y ancho; el tamaño, el grado de desplazamiento y localizaciones del septum infundibular dentro del TSVD, el grado de hipertrofia del septum y otros componentes del infundibulo (14).
Indicaciones menos comunes de reoperación son insuficiencia tricúspidea, defecto septal auricular, estenosis perifericas de la arteria pulmonar, shunt quirúrgico residual, colaterales paracardiacas, arritmias ventriculares. La atención de los detalles quirúrgicos, en la operación inicial puede reducir la necesidad de reoperación en pacientes con TOF (18).
BIBLIOGRAFIA
1. Fallot A. Contribution
a l`anatomie pathologique de la maladie bleue (cyanose cardiaque). Marseille
Med 25:77, 138, 207, 270, 341, 403, 1888.
2. Blalock A,Taussig HB.
The surgical treatment of malformations of the heart in which there is
pulmonary stenosis or pulmonary atresia. JAMA 128: 189, 1945.
3. Potts WJ, Smith S, Gibson
S. Anastomosis of the aorta to a pulmonary artery. JAMA 132: 627, 1946.
4. Davidson JS. Anastomosis
between the ascending aorta and the main pulmonary artery in the tetralogy
of Fallot. Thorax 10: 348, 1955.
5. Waterston D. Leceni fallotovy
tetralogie u deti do jednoho roku veku. Rozhl chir XLI: 3, 1962. Citado
por: Castañeda AR, Jonas RA, Mayer JE, Hanley FL. Tetralogy of Fallot.
En Castañeda AR, Jonas RA, Mayer JE, Hanley FL, eds. Cardiac surgery
of the neonate and infant. Philadelphia: W. B. Saunders Company, 1994:
215.
6. Klinner VW, Pasini M,
Schaudig A. Anastomose zwischen system- und lungenarterie mit hilfe von
kunststoffprothesen bei cyanotischen herzvitien. Thoraxchirurgie 10: 68,
1962. Citado por: Castañeda AR, Jonas RA, Mayer JE, Hanley FL. Tetralogy
of Fallot. En Castañeda AR, Jonas RA, Mayer JE, Hanley FL, eds.
Cardiac surgery of the neonate and infant. Philadelphia: W. B. Saunders
Company, 1994: 215.
7. Laks H, Castaneda AR.
Subclavian arterioplasty for the ipsilateral Blalock Taussig shunt. Ann
Thorac Surg 19: 319, 1975.
8. de Leval MR, McKay R,
Jones J, et al. Modified Blalock Taussig shunt. Use of subclavian artery
orifice as flow regulator in prosthetic systemic- pulmonary artery shunts.
J Thorac Cardiovasc Surg 81: 112, 1981.
9. Sellors TH. Surgery of
pulmonary stenosis (a case in which pulmonary valve was successfully divided).
Lancet 1: 98, 1948.
10. Brock RC, pulmonary
valvulotomy for relief of congenital pulmonary stenosis. Report of tres
cases. Br Med J I: 1121, 1948.
11. Lillehei CW, Cohen M,
Warden HE, et al. Direct vision intracardiac surgical correction of the
tetralogy of Fallot, pentalogy of Fallot and pulmonary atresia defects:
report of first ten cases. Ann Surg 142: 418, 1955.
12. Kirklin JW, DuShane
JW, Patrick RT, et al.Intracardiac surgery with the aid of a mechanical
pump-oxygenator system (Gibbon type): report of eight cases. Proc Staff
Meet Mayo Clin 30: 201, 1955.
13. Mohri A, Dillard DH,
Grawford EW, Martin WE, Merendino KA: Method of surface-induced deep hypothermia
for open heart surgery in infants. J Thorac Cardiovasc Sug 58: 262, 1969.
14. Valdes Cruz LM, Cayre
RO. Echocardiographic diagnosis of congenital heart disease An embryologic
and anatomic approach. Philadelphia: Lippincott-Raven Publishers 1999.
15. Castañeda AR,
Jonas RA, Mayer JE, Hanley FL. Tetralogy of Fallot. En Castañeda
AR, Jonas RA, Mayer JE, Hanley FL, eds. Cardiac surgery of the neonate
and infant. Philadelphia: W. B. Saunders Company, 1994: 215.
16. Arqueé- Gibernau
JM, Quero- Jiménez M, Alvarez- Díaz F, Cabo- Salvador FJ,
Sánchez PA. Tetralogía de Fallot. En: Sánchez PA,
ed. Cardiología pediátrica. Barcelona: Salvat editores, 1986:
Tomo I: 365- 403.
17. Kirklin JW, Barrat-
Boyet BG. Cardiac surgery. New York: John Wiley & Sons, 731, 732, 735,
786- 789.
18. Backer CL, Idriss FS.
Reoperation after initial repair of Tetralogy of residual or recurrent
defects. En: Marshall LJ, William IN, ed. Pediatric cardiac surgery. Boston:
Butterworth-Heinemann, 1992: 91-103.
Ir al Indice General Ir a la Tapa de la Revista Volver a la página de la Facultad