Revista de Posgrado de la VIa Cátedra de Medicina - N° 117 – Julio 2002
Pág. 18-21
METABOLISMO OSEO: ACTUALIZACION
Montenegro Sergio Daniel, Pedroza Nuñez Ivana Jesica, Vargas Eced Segundo
Prof. Dr.Miguel H. Ramos
INTRODUCCION
En la actualidad hay mucha información disponible acerca de la fisiología de la remodelación ósea, y de los factores locales y sistémicos que regulan este complejo proceso, pero aun no hay suficientes datos sobre lo que ocurre a nivel molecular. Los nuevos avances en la biología molecular han permitido descubrir los mecanismos que se desarrollan a nivel celular en el microambiente óseo.
La importancia que reviste este tema radica en que continua la mejoría en los servicios de salud de todo el mundo, como así también en la cantidad y calidad de vida, lo que lleva a un aumento de la expectativa de vida de la población, por lo tanto cada día hay mas y mas personas expuestas a las consecuencias que puedan desencadenar los desordenes en el metabolismo óseo. Los esfuerzos de la ciencia para controlar sus efectos han dado frutos muy significativos, tanto en el conocimiento de la patogenia como así también en la forma de diagnosticarlas, monitorizarlas y tratarlas con éxito. El objetivo de este trabajo es dejar claro los mecanismos que se desarrollan en el microambiente óseo de manera que, en adelante, se deduzcan una amplia gama de posibilidades terapéuticas basadas en su conocimiento.
Fisiología Osea
Una vez alcanzada la masa ósea máxima, lo cual ocurre hacia el fin de la tercera década de la vida, el mantenimiento de la misma depende de un complejo y equilibrado proceso de remodelación ósea, con sus dos fases fundamentales: la resorción (que dura cerca de 3 semanas por sitio), comandada por los osteoclastos, y la formación (fabricación y depósito de matriz extracelular ósea), llevada a cabo por los osteoblastos y que tarda 3 a 4 meses. En ellas intervienen numerosos factores sistémicos de naturaleza inmuno-endocrina, así como elementos de regulación local (1)
Está formado por dos componentes fundamentales: las células y la matriz extracelular. Esta última es particularmente abundante en este tejido y está compuesto por fibras colágenas y por proteínas no colágenas.
Las células encargadas del proceso de remodelación son: los osteoblastos que se encargan de la formación de "hueso nuevo", y los osteoclastos encargados de la eliminación de "hueso viejo" (resorción).
Todo esto se halla bajo la dirección de un sistema de señales hormonales a su vez modulada por factores locales óseos que mantienen un equilibrio.
La PTH (Parathormona) se secreta por las glándulas paratiroideas y es importante para el mantenimiento de la calcemia. Esta hormona aumenta la resorción ósea, aumenta la reabsorción tubular renal de calcio, y aumenta la absorción intestinal de calcio estimulando la síntesis renal de 1,25-vitamina D; por lo tanto aumenta la calcemia. Su secreción aumenta cuando desciende la calcemia y disminuye cuando esta aumenta.
La Vitamina D es producida principalmente por la piel. En la piel se sintetiza por la acción de la luz solar sobre el 7-dehidrocolesterol; pero debe transformarse en 1,25-vitamina D, para ejercer actividad biológica. Esta transformación se produce principalmente en el riñón por estímulo de la PTH. Produce un aumento en la absorción intestinal de calcio, manteniendo los niveles normales de calcemia contribuyendo a la normal mineralización del hueso.
La Calcitonina es una hormona secretada por las células C de la glándula tiroides. Su secreción se estimula por varios factores, entre ellos el aumento de la calcemia. Sus efectos predominantes son el descenso de la resorción ósea y de la reabsorción tubular renal de calcio.
Otras hormonas actúan sobre el metabolismo del calcio y del hueso, como los esteroides gonadales y suprarrenales, la tiroxina, la insulina y la hormona del crecimiento, aunque, a diferencia de las hormonas calciotropas, su secreción no depende principalmente de la concentración extracelular de calcio.
La concentración de las hormonas que regulan el metabolismo del calcio determina la dirección del recambio óseo, pero los factores locales modulan el efecto final y, a su vez, modifican la concentración de las hormonas y la respuesta biológica a nivel de los osteoblastos y los osteoclastos (2).
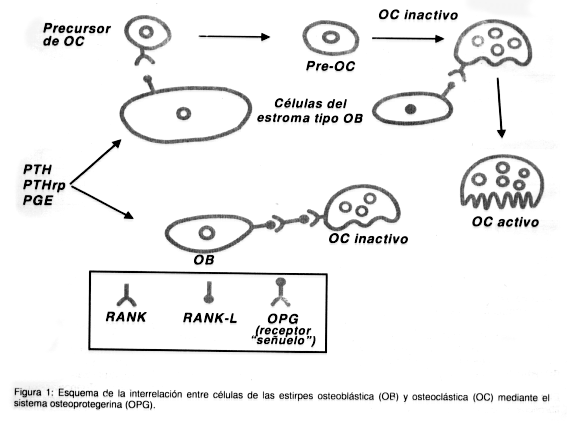
Un nuevo sistema de señales entre las células óseas (3)
Las células del estroma osteblástico estan esencialmente implicadas en la función y diferenciación osteoclástica a traves del contacto célula-célula. (4 )
Algunos estudios demostraron la presencia de un factor en la membrana de las células osteoblásticas, miembro de la superfamilia de ligandos del FNT ( Factor de Necrosis Tumoral): el RANKL (Ligando Receptor del Activador delFactor Nuclear Kappa-B). Su producción es máxima en las células indiferenciadas del estroma y se reduce a medida que madura el fenotipo osteoblástico. Estimula la diferenciación, sobrevida y fusión de las células precursoras de osteoclastos, activa los osteoclastos maduros y prolonga su vida útil. Como resultado permite la expansión de la masa osteoclástica activa capaz de formar sitios de resorción ósea.
Los efectos del RANKL están mediados por su unión a un receptor altamente especifico: el RANK, al cual activan. Es una proteína transmembrana expresada por los osteoclastos. La unión del RANK ( Receptor del Activador delFactor Nuclear Kappa-B ) con su ligando (RANKL) induce la activación de una cascada de eventos intracelulares que llevan a la diferenciación y activación de los osteoclastos.
Se logro identificar una proteína que inhibe el desarrollo de osteoclastos: la OSTEOPROTEGERINA(OPG) también miembro de la superfamilia de receptores del TNF que funciona como un factor soluble segregado por los osteblastos no anclados a la membrana. Actúa como receptor señuelo uniéndose al RANKL y neutralizándolo, ocupa e impide su unión con el RANK. Inhibe la diferenciación, sobrevida y fusión de los precursores de osteoclastos, bloquea la activación de los osteoclastos maduros e induce a su apoptosis (5).
En resumen, para diferenciarse y madurar las células de estirpe osteoclástica deben tener contacto directo con los osteoblastos, interrelación mediante la unión de un receptor a su ligando presentes en las respectivas membranas. Si hay suficiente OPG en el medio se unirá al RANKL de los ostoblastos impidiendo su interacción con el RANK de los precursores osteoclásticos lo que frenara el proceso de funcionalización osteoclástica.

Esquema de la interrelación entre células de las estirpes osteoblásticas (OB) y osteoclástica (OC) mediante el sistema osteoprotegerina (OPG) (3)
RANK-L / OPG-L / ODF / TRANCE: EL LIGANDO(6)
Todas estas diferentes siglas fueron los nombres con el que fue designado el ligando RANKL, hasta llegar al consenso general de designarlo con este ultimo nombre. (7)
Esta molécula es un nuevo miembro de la familia de ligandos del TNF. Es un polipéptido de 317 aa. Su mayor producción en el hueso y en la medula ósea esta dado por células estromales de medula ósea, osteoblastos, condrocitos, celulas del mesenquima, periostio, osteoclasto, celulas endoteliales y celulas T. Tambien se ha encontrado el RNAm del RANKL en tejidos extraesqueleticos, cerebro, corazón, riñon, músculo esquelético y piel. Su producción es mayor en células estromales indiferenciadas, mientras que es reducida en células mesenquimales multipotenciales que terminan en el fenotipo osteoblástico….
El gen promotor de RANKL contiene elementos que responden a glucocorticoides y a vitamina D, como también al factor esencial de transcripción osteoblástica (cbfa-1).
En experimentos in vitro el RANKL demostró estimular la diferenciación, sobrevida y fusión de células precursoras osteoclásticas para activar osteoclastos maduros y para prolongar su lapso de vida por inhibición de la apoptosis, de esta manera aumenta el pool de osteoclastos capaces de formar lagunas de resorción.
Otros factores como el factor transformante beta y la PGE2 pueden cooperar con la acción del RANKL.
La administración parenteral de RANKL recombinante en ratones in vivo provocan osteoporosis severa asociado con aumento de la actividad osteoclástica, perdida ósea rápida y severa hipercalcemia. En contraste, ratones deficiente en RANKL tiene severa osteopetrosis, alteración de la erupción dentaria y faltas de osteoclastos maduros, indicando que el RANKL es requerido para la activación y diferenciación osteoclástica.
RANK: EL RECEPTOR. (6)
El efecto del RANKL esta mediado por la unión a su receptor especifico RANK que provoca activación y diferenciación osteoclástica. Esta es una proteína transmembrana de 616 aa., su expresión esta limitada a los osteoclastos, células B y T, células dendríticas y fibroblastos. La activación del RANK induce la osteoclastogenesis in vitro. En modelos in vivo la presencia de RANK es esencial para la diferenciación y activación osteoclástica. Ratones transgénicos con sobreexpresión de RANK exhiben un fenotipo osteopetrotico y descienden la ostoclastogenesis.
La expresión del RANK sobre células osteoclásticas es estable y con una pequeña regulación por agentes osteotropicos, a diferencia del RANKL y de la OPG que están regulados por múltiples factores.
OPG: EL RECEPTOR SEÑUELO(6)
La OPG o factor inhibidor de la osteoclastogenesis es un nuevo miembro de la superfamilia de receptores del TNF. No tiene dominio transmembrana. Es un propeptido de 401 aa. A diferencia del RANKL y el RANK cuya expresión es restringida, la OPG es expresada en altas concentraciones por una variedad de tejidos y tipos de células. En hueso, la OPG es principalmente producida por células de la línea osteoblástica, con aumento de la producción en células mas diferenciadas.
La OPG es un receptor señuelo, actúa neutralizando el RANKL. In vitro la OPG inhibe la diferenciación, sobreviva y fusión de las células precursoras osteoclásticas, bloqueando la activación de osteoclastos maduros e induciendo su apoptosis.
La sobreexpresion de OPG en ratones transgenicos es asociado con severa osteopetrosis, similar a lo que sucede en ratones sin RANK y sin RANKL. En contraste, la disminución de la expresión de OPG se asocia a severos cuadros de osteoporosis, aumento de la actividad osteoclastica, como asi tambien calcificacion arterial severa, lo que indica el papel protector de la osteoprotegerina en el sistema vascular.
La administración parenteral de OPG recombinante en roedores normales produce aumento de la masa osea y previene la perdida ósea inducida por ovariectomía sin los efectos colaterales esqueléticos y extraesqueléticos. Esta acción también es mediada por la leptina, una proteína que es secretada por la masa grasa corporal, pues estimula la producción de OPG (8)
AGENTES QUE REGULAN EL SISTEMA RANKL/OPG/RANK.
Muchas de las hormonas reguladoras del Ca++ y citoquinas, incluyendo vitamina D3, PTH, PGE2 e IL-11 actúan estimulando la osteoclastogenesis a través de la doble acción de inhibir la producción de osteoprotegerina y estimulando la producción de RANKL, al igual que los glucocorticoides(10). En el otro extremo están los estrógenos que actúan inhibiendo la producción de RANKL (9).
La producción de OPG es estimulada por las citoquinas proinflamatorias, IL 1 , IL 11, FNT á y â, TGF â, estrógenos y Ca++. Mientras que disminuye por la PG E2, GCC, Calcitriol y PTH.
Si bien RANKL y OPG estan regulados por varios factores, la expresión de RANK sobre células osteoclásticas se basa en ser estable con una pequeña regulación por agentes osteotrópicos. Como siempre, en el sistema inmune la expresión de RANK sobre celulas T está regulada en más por la IL 4 y el TGF â, la expresión de RANK sobre células dendríticaes es regulada en menos por el ligando CD 40 (6).
El siguiente cuadro resume la acción de los diferentes agentes sobre la regulación de RANKL y OPG en células de la estirpe osteoblástica.
|
FACTOR |
RANKL |
OPG |
|
CALCIO |
estimula |
estimula |
|
PARATHORMONA |
estimula |
inhibe |
|
CALCITRIOL |
estimula |
inhibe |
|
PROSTAGLANDINA E2 |
estimula |
inhibe |
|
GLUCOCORTICOIDES |
estimula |
inhibe |
|
ESTROGENOS |
estimula |
estimula |
|
FACTOR TRANFORMANTE â |
inhibe |
estimula |
|
INTERLEUKINA-1á |
estimula |
estimula |
|
INTERLEUKINA-1â |
estimula |
estimula |
|
INTERLEUKINA 6 |
estimula |
|
|
INTERLEUKINA 11 |
estimula |
estimula |
|
FACTOR DE NECROSIS TUMORAL á |
estimula |
estimula |
|
FACTOR DE NECROSIS TUMORAL â |
estimula |
CONCLUSION.
La comprensión de este complejo sistema de señales se basa en que el RANKL induce la activación del RANK constituyendo un sistema de segundo mensajero, ambos necesarios y suficientes para la funcionalización osteoclástica, así como también cambios en la relación RANKL/OPG son la base que está asociada con la diferenciación y activación osteoclástica.
Podemos deducir entonces que no fueron en vano los intentos realizados para aclarar el mecanismo íntimo del microambiente proporcionado por las células óseas, cuya identificación de los tres componentes y la posterior caracterización de sus efectos a sido realizada in vivo e in vitro (6).
Si bien las mayoría de los estudios realizados hasta ahora son de tipo experimental en roedores, han aumentado las evidencias de que las mismas vías operan en los seres humanos: algunos precursores de osteoclastos en sangre periférica pueden ser diferenciados a osteoclastos por RANKL; la osteoprotegerina esta presente en la circulación de adultos normales y tanto ella como el RANKL se expresan en tejidos humanos. (10)
Siguiendo esta línea de estudios se establecerán nuevos caminos en el tratamiento de las enfermedades severas del metabolismo óseo, ya sea por exceso (osteoporosis) o déficit (osteopetrosis) de la función osteoclástica.
BIBLIOGRAFIA
Guyton. Tratado de fisiología médica. 7ª edición. México. Editorial Interamericana.1989. Cap.79. Pag 933-941
Murria RK, Mayes PA, Granner DK, Rodwell VW. Bioquímica de Harper. 13ª edición. México. Editorial El manual moderno. 1994. Cap 47. 609-17.
Sanchez A, Sedlinsky C. La osteoprotegerina y otros factores reguladores de la resorción ósea. Osteology 2001,4: 456-60.
Suda T, Takahashi N, Udagawa N, Jimi E, Gillespie MT, Martin TJ. Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families. Endocr Rev 1999, 20: 345-57
Simonet WS, Lacey DL, Dunstan CR , Kelley M. Osteoprotegerin: a novel secreted protein involved in the regulation of bone density. Cell 1997,89:159-61.
Lorenz C.,Hofbauer and Armin E. Heufelder. The Role of Receptor Activator of Nuclear Factor-KB Ligand and Osteoprotegerin in the Pathogenesis and Treatment of Metabolic Bone Diseases. J Clin Endocrinol Metab 2000; 85:2355-63.
The American Society for Bone and Mineral Reserch President`s Committee on Nomenclature. Proposed standard nomenclature for new tumor necrosis factor family members involved in the regulation of bone resorption.Bone Miner Res 2000 ,15:2293-6.
Burguera B, Hofbauer LC, Thomas T, Gori F, EvansGL, Khosla S, Riggs BL, Turner RT. Leptin reduces ovariectomy-induced bone loss in rats. Endocrinology 2001 ,142:3546-53.
Aubin JE, Bonnelye E. Osteoprotegerin and its ligand: a new paradigm for regulation of osteoclastogenesis and bone resorption. Osteoporos Int 2000, 11: 905-13
Hofbauer LC, Gori F, Riggs BL, Lacey DL. Stimulation of osteoprotegerin ligand and inhibition of osteoprotegerin production by glucocorticoids in human osteoblastic lineage cells: potential paracrine mechanisms of glucocorticiod-induced osteoporosis. Endocrinology 1999 140:4377-81