Revista de Posgrado de la VIa Cátedra de Medicina - N° 118 – Agosto 2002
Pág:
Dr. Eduardo L. Rodríguez
Hospital R. Billinghurst. Clínica y Cardiología. Ituzaingó, Corrientes.
Dr. José R. O. Gómez.
Servicio de Cardiología. Laboratorio de Ecocardiografía y Doppler. Hospital “Angela I. de Llano”. Corrientes
La insuficiencia valvular mitral (IM) es la incapacidad de la válvula mitral (VM) para prevenir la regurgitación de sangre desde el ventrículo izquierdo (VI) hacia la aurícula izquierda (AI) durante la sístole, lo que puede deberse a una alteración funcional o anatómica del aparato valvular mitral.
La IM fué diagnosticada por primera vez por Corvisart en 1803 y en 1832 Hope describió el soplo sistólico apical regurgitante que la caracteriza.
Hay cerca de 500.000 diagnósticos nuevos de insuficiencia mitral (IM) anualmente en USA. De igual manera la prevalencia estimada de IM es confundida por la prevalencia de soplos inocentes en muchos adultos y por el hecho que la ecocardiografía Doppler detecta IM fisiológicas en el 80% de los adultos.1
La IM, al igual que todas las lesiones valvulares cardíacas agudas y crónicas, impone una sobrecarga hemodinámica al corazón.
El médico cardiólogo clínico frente a un paciente con IM tiene al menos dos grandes preguntas clínicas a responder:
1. ¿...Es la magnitud de la IM de suficiente severidad para causar síntomas o disfunción VI y de esta forma merece tratarse...?
2. ¿...Cuál es el tiempo y el tipo de tratamiento que corresponde para cada IM...?
Los avances en la ecocardiografía y Doppler ayudan al clínico a responder a la primera pregunta con mayor precisión, si bien, esto no está todavía lo suficientemente perfeccionado.
Para responder a la segunda pregunta, el tratamiento para todas las enfermedades valvulares severas de última involucra la corrección mecánica.
Todas las técnicas de imagenología continúan evolucionando y la elección del momento para la cirugía de reparación o reemplazo valvular, el riesgo de la operación es sopesado contra la presencia disfunción ventricular irreversible, algo que ocurriría si se retarda la operación.
Objetivos de la presente revisión:
1. Analizar algunas variables hemodinámicas (no invasivas e invasivas) que influencian la interpretación del cuadro de una IM.
2. Evaluar la severidad y la presencia de disfunción ventricular en la IM por ecocardiografía y Doppler.
3. Seleccionar el tipo de tratamiento en la IM más adecuado para cada caso, basado en la evidencia científica.
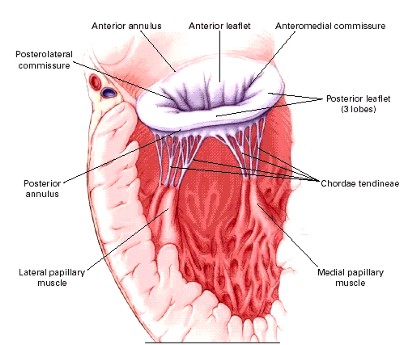
La VM está compuesta por el anillo mitral, las valvas, las cuerdas tendinosas, y los músculos papilares (Fig. 1). La anormalidad de cualquiera de estas estructuras puede causar IM primaria -primaria, indicando que una anormalidad en los componentes de la válvula es la responsable de la IM-.
Por otro lado, enfermedades del VI que llevan a dilatación ventricular (ej. Miocardiopatia dilatada) pueden causar un mal alineamiento de los músculos papilares y agrandamiento del anillo, produciendo IM “secundaria” al proceso que afecta al VI.
Las causas más comunes de IM severa son prolapso valvular mitral (PVM) (20-70%), isquemia (13-30%), enfermedad reumática (3-40%) y endocarditis (10-12%). Aunque el PVM es común en las series quirúrgicas, la mayoría de los pacientes con PVM tienen solo IM leve y nunca necesitaran cirugía.
El PVM (simétrico y asimétrico) y la enfermedad arterial cardíaca isquémica, ambas son comunes en los pacientes con IM leve, pero la causa más común de IM es la dilatación ventricular y la disfunción VI sistólica.
La endocarditis bacteriana y las colagenopatías como el lupus eritematoso y la enfermedad valvular reumática, son causas menos comunes en la práctica diaria.
La identificación exacta del mecanismo de la IM -causa y severidad- es esencial para guiar el tratamiento médico y la necesidad potencial de cirugía de reparación o reemplazo valvular.
En el anciano la IM puede deberse a calcificación del anillo (Fig. 2) en forma típica, presentan IM leve a moderada y una intervención es raramente necesaria.

Figura 1. Aparato valvular mitral
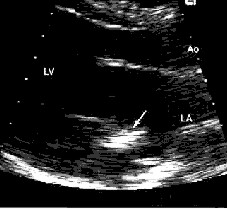
Figura 2. Eje largo paraesternal (izq.) y eje corto (der.) mostrando calcificación del anillo.
La enfermedad valvular mitral inducida por serotonina ha sido rara hasta ahora, debido a que ocurría solamente en el síndrome carcinoide y en concomitancia de un foramen oval permeable que permite el cortocircuito del flujo desde los pulmones hacia las válvulas y cavidades izquierdas.
También la combinación de drogas anorexígenas como la fenfluramina y fentermina -prescriptas aproximadamente a ~ 5 x 106 personas- para inducir la pérdida de peso, se ha reconocido como causa de enfermedad cardíaca valvular con IM.
Aunque existen reportes ecocardiográficos que indican que la suspensión de éstas drogas anorexígenas por un período de tiempo determinado, se acompañaban de reversión e incluso desaparición del cuadro clínico de IM.
|
AGUDAS |
|
Alteraciones del anillo mitral |
|
Endocarditis infecciosa (formación acceso) |
|
Trauma (cirugía valvular) |
|
Pérdida paravalvular por interrupción de sutura (problemas técnicos o EI) |
|
Alteraciones de las valvas |
|
EI (perforación o interferencia del cierre por vegetación) |
|
Trauma (rotura durante valvotomía con balón o trauma penetrante) |
|
Tumores (mixoma auricular) |
|
Degeneración mixomatosa |
|
Lupus eritematoso sistémico (lesión Libman-Sacks) |
|
Rotura de cuerdas tendinosas |
|
Idiopática |
|
Degeneración mixomatosa (PVM, síndrome Marfan, síndrome Ehlers-Danlos) |
|
EI |
|
Fiebre reumática aguda |
|
Trauma (valvotomía con balón, trauma cerrado tórax) |
|
Alteraciones músculos papilares |
|
Enfermedad coronaria (disfunción o ruptura) |
|
Disfunción VI global aguda |
|
Enfermedad infiltrativa (amiloidosis, sarcoidosis) |
|
Trauma |
|
Alteraciones de prótesis VM |
|
Perforación de valvular Porcina (EI) |
|
Degeneración válvula porcina |
|
Falla mecánica |
|
Inmovilización del disco o la bola de la prótesis mecánica |
|
|
CRONICAS |
|
Inflamatoria |
|
Reumatismo cardiaco |
|
LES |
|
Esclerodermia |
|
Degenerativa |
|
Degeneración mixomatosa de la VM (síndrome clic-soplo de Barlow, valva prolapsante, MVP) |
|
Síndrome Marfan |
|
Síndrome Ehlers-Danlos |
|
Pseudoxantoma elasticum |
|
Calcificación del anillo mitral |
|
Infecciosa |
|
EI afectando valvas normales, anormales o protésicas |
|
Estructural |
|
Ruptura cuerdas (espontánea o secundaria a IAM, trauma, PVM, EI) |
|
Ruptura y disfunción de MP (isquemia o IAM) |
|
Dilatación del anillo y el VI (miocardiopatia congestiva, dilatación aneurismática del VI) |
|
Miocardiopatia hipertrófica |
|
Pérdida peri-protésica |
|
|
CONGENITAS |
|
Fenestraciones (cleft) de VM |
|
Defecto de almohadillas endocárdicas. |
|
Fibroelastosis endocárdica. |
Tabla 1. Causas de Insuficiencia mitral crónica.
Normalmente el VI eyecta la totalidad de su volumen sistólico (VS) en la aorta. En la IM porción del VS es eyectado en la AI, substraído del flujo anterógrado que perfunde a los órganos vitales.
La progresión de la IM puede ser separada en tres estadios (Fig. 3). En la IM aguda, (rotura de cuerdas) hay una caída súbita del VS anterógrado. El volumen de llenado VI (regurgitante y anterógrado) causa sobrecarga diastólica y da como resultado un incremento en el estiramiento del sarcómero. Dado que el VI normalmente opera con un estiramiento del 90% de su máxima longitud, la sobrecarga de volumen puede causar solo un modesto incremento en el volumen de fin de diástole.
El aumento de la longitud del sarcómero en diástole permite al VI generar más trabajo y eyectar un mayor VS. Hay reducción de la poscarga VI debido a que el orificio extra reduce la impedancia del VI al vaciamiento, además de disminuir el volumen de fin de sístole (VFS). El volumen de fin de diástole (VFD) aumentado y la disminución del VFS aumenta el VS total; no obstante el VS anterógrado es aún marcadamente disminuído comparado con la situación normal. Al mismo tiempo la sobrecarga de volumen sobre la AI aumenta la presión auricular, produciendo congestión pulmonar. Durante esta fase, el paciente tiene insuficiencia cardiaca congestiva (ICC), aunque la función del músculo VI es totalmente normal, por lo menos en la IM primaria no isquémica.
En algunos casos, la IM aguda requiere corrección mecánica urgente y cirugía valvular. Si el manejo médico es exitoso en estabilizar al paciente con IM aguda, este puede evolucionar a la fase crónica de compensación (Fig. 3, B) en los próximos meses. Durante este lapso, se desarrolla dilatación VI e hipertrofia excéntrica (HVI) produciendo un gran incremento en el VFD. El incremento de la poscarga o estrés parietal de fin de sístole, aumenta desde un valor subnormal a un valor normal, conforme el radio VI aumenta.
Fig. 3 A, Normal (línea superior) vs. IM aguda (línea inferior); B, IM aguda vs. IM crónica compensada; C, IM crónica compensada vs. IM crónica descompensada.
Estrés = Presión x Radio / espesor x 2 (Ley de Laplace)
La HVI excéntrica, la precarga aumentada y poscarga normal con una función contráctil normal, permiten la eyección de un gran VS total. La fracción regurgitante permanece alta, el gran VS total compensa el VR por un VS aumentado. En esta etapa, la AI también se dilata acomodando el VR, y reduciendo la presión AI. El paciente ahora tiene un volumen minuto (VM) casi normal con presiones AI y venosas pulmonares tolerables, permaneciendo asintomático aún durante actividades extremas.
El paciente puede mantenerse en la fase crónica compensada por un período prolongado. Si la sobrecarga de volumen es suficientemente severa, ocasionalmente la función contráctil disminuye, y ocurre la descompensación. En ésta fase, el VI debilitado deteriora su eyección y aumenta el VFS, resultando en una disminución tanto del VS total como el VS anterógrado. La dilatación VI adicional puede ocurrir, resultando en un aumento repetido de la presión de fin de diástole (PFDVI) y de la AI. Aunque la regurgitación extra en la AI permite descargar al ventrículo, la dilatación progresiva del VI (en sístole como en diástole), aumentan más la poscarga, empeorando el rendimiento de la fracción de eyección VI (FE).2 Los síntomas de ICC pueden aparecer en ésta fase, aunque muchos ingresan a la fase de función contráctil disminuída mientras permanecen relativamente asintomáticos. Es importante resaltar que aunque la FE está reducida desde la fase de compensación crónica, la FE puede aún ser mantenida en el rango “normal” por un aumento de la precarga.
Los estudios que se han efectuado a la fecha sugieren una reducción en la liberación de calcio, lo cual altera el acoplamiento excitación-contracción, es una causa de disfunción contráctil en la IM, Se describió que el Forskolin, que aumenta el pico de calcio intracelular por el AMPc, restaura este déficit.
En resumen los datos que se tienen actualmente indican que el déficit contráctil en la IM es el resultado de un defecto contráctil en el miocito propiamente dicho. Este defecto es causado en parte por la pérdida de elementos contráctiles y también parece ser causado por una anormalidad en el manejo del calcio y el acoplamiento excitación-contracción.
Se ha observado que la cantidad de HVI que se produce en la IM es relativamente limitada tanto en estudios de experimentación con perros como en humanos. 3 Cuando se comparan las lesiones valvulares del lado izquierdo que causan sobrecarga hemodinámica, el menor incremento de masa se observa en la IM.
El tipo de remodelamiento que ocurre es aquél en el cual hay un incremento relativamente grande en el radio comparado con el espesor. Esto a su vez se asocia con una relación masa / volumen reducida. En otras palabras, hay menos masa VI para bombear el volumen requerido al VI en la IM. Es lógico pensar que en ausencia de un “adecuada” HVI para compensar la sobrecarga hemodinámica en esta enfermedad, debería haber activación de varios sistemas neurohumorales, especialmente el sistema nervioso adrenérgico. Esto lleva a la pregunta de si la sobrestimación b-adrenérgica podría ser una causa de la pérdida de elementos contráctiles que fué observada en perros en la IM. Datos de modelos en perros avalan la probabilidad que la activación b-adrenérgica debida a la falta de HVI compensadora sea la principal causa de déficit contráctil. 3 Es llamativo que la súbita y severa sobrecarga de volumen de la IM no estimule un incremento en el crecimiento miocárdico. Los factores que expliquen este fuerte contraste con la rápida inducción de síntesis proteica como se ve en la sobrecarga de presión permanecen desconocidos.
En la mayoría de las enfermedades cardiacas que causan IC, hay elementos de disfunción sistólica y diastólica al mismo tiempo. Los estudios de disfunción diastólica en modelo canino, sin embargo, demuestran que la rigidez muscular fue normal y que la rigidez de cámara fue subnormal, probablemente debido a la disminución relativa del espesor. La rigidez reducida permite un llenado muy rápido del VI, permitiendo acomodar la sobrecarga de volumen diastólico. 4.5 Únicamente en los pacientes con disfunción sistólica concomitante la rigidez diastólica aumenta para volverse normal. De esta manera la IM es una circunstancia inusual, en la cual, la falla cardiaca sistólica ocurre acompañada de una función diastólica que es supernormal o en el peor de los casos normal.
Diagnóstico de IM.
Como ocurre con cualquier enfermedad cardiaca, el diagnóstico comienza con una historia clínica y examen físico minucioso. Además de interrogar la presencia de síntomas clásicos de ICC e intolerancia al ejercicio que pueden ocurrir en la IM, se deben investigar causas potenciales específicas. El paciente debe ser interrogado por antecedentes o historia de fiebre reumática, por la presencia de colagenopatías vasculares y por el uso de ergotamina o fenfluramina. Si hay sospecha de síndrome de PVM, la fecha del diagnóstico es importante.
Previo a 1987, no se había reconocido la forma en silla de montar de la VM, y así el prolapso que se ve solamente en la vista de 4 cámaras era considerada adecuada para hacer el diagnóstico. Ahora en cambio se reconoce que el PVM debe ser confirmado en el eje largo paraesternal. Durante la entrevista, un interrogatorio cuidadoso buscando la presencia de síntomas o aún cambios sutiles en el estilo de vida que hacen que el paciente se encuentre más sedentario. El comienzo de los síntomas o los cambios en la tolerancia al ejercicio, ambos constituyen un resumen de la condición fisiológica del paciente y dan una información global del estado clínico, haciendo prescindibles algunos exámenes invasivos y no invasivos.
Muchos
pacientes que reciben un diagnóstico de PVM son incorrectamente diagnosticados
después de un ecocardiograma, y este error diagnóstico continúa cometiéndose
por parte de los ecocardiografistas cuando no han integrado una visión
tridimensional de la válvula mitral en su práctica de rutina. Hay un rango de
variantes normales de la VM que se observan en el eco de un paciente normal, y
pueden ser confundidas con válvulas prolapsantes. Los pacientes con IM
significativa causada por válvulas mixomatosas tienden a ser bastante fáciles
de identificar en el ecocardiograma, y la mayoría de las controversias ocurren
en el paciente con IM mínima o ninguna.
La
IM se sospecha habitualmente durante el exámen físico cuando se escucha el típico
soplo holosistólico apical. Este soplo generalmente irradia a la axila o a la
espalda. Hay una débil correlación entre la intensidad del soplo y la
severidad de la insuficiencia. La intensidad del soplo es generalmente
independiente de la longitud del ciclo. Si la IM es por un PVM, puede escucharse
en la sístole tardía; prolongándose durante las maniobras que reducen el
volumen VI (Ej. Valsalva). Cuando la IM empeora, el soplo se hace más holosistólico
y un poco más audible. En la IM aguda el soplo puede ser relativamente breve
por la sobrecarga de volumen en la AI no complaciente produce una gran onda V,
que a su vez reduce el gradiente entre el VI y la AI a mitad de la sístole,
acortando al soplo.
Si
la IM es severa y prolongada, se produce agrandamiento de la aurícula y el VI.
Durante el exámen físico el agrandamiento de las cámaras es detectado como
una elevación sistólica paraesternal izquierda y un choque de la punta
agrandado y desplazado. En la medida que la enfermedad progresa, se desarrolla
hipertensión pulmonar y esto se manifiesta durante el esfuerzo con un
componente pulmonar intenso del segundo ruido, por una elevación del VD, y por
una elevación de la presión en las venas del cuello, si se ha desarrollado
insuficiencia cardiaca derecha. La hipertensión venosa sistémica a su vez
produce ascitis y edemas periféricos.
El ECG en la IM es inespecífico. Aunque puede haber anormalidades de la AI con HVI por criterios de voltaje. En algunos casos, la onda T son altas las precordiales izquierdas en concordancia con un voltaje elevado, un signo de “sobrecarga diastólica” a diferencia de la T invertidas que ocurren en la sobrecarga de presión. La presencia de ondas Q puede indicar el origen isquémico del problema.
La radiografía de tórax muestra agrandamiento del VI y AI y congestión pulmonar si las presiones izquierdas están aumentadas.
Ecocardiografía y Doppler
El ECG y la Rx son útiles para sospechar la IM severa pero no son un
prerrequisito para hacer el diagnóstico. Sin embargo la ecocardiografía es
indispensable en la evaluación global de la IM.
El
ecocardiograma mide la extensión de la dilatación VI, la extensión del
agrandamiento AI, la presencia de disfunción VI (para decidir el momento quirúrgico),
y la severidad de la IM.
La
severidad de la IM se valora en parte por el impacto sobre el volumen AI y VI, a
menos que la enfermedad haya sido tan aguda que no hubo tiempo para la repercusión
tuviera lugar (Figura 4)
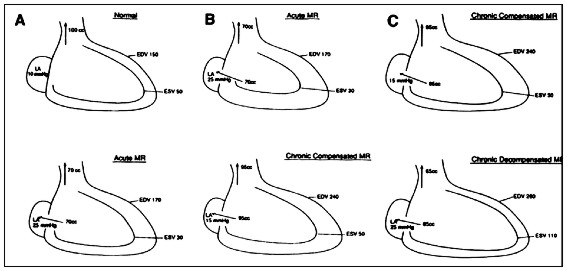
Fig. 4 IM severa, flail parcial valva posterior (A), VI tamaño normal, función sistólica conservada (FE 0.66) moderado crecimiento AI
Si la IM es crónica severa la AI y VI están dilatadas y adaptadas a la sobrecarga de volumen. La falta de dilatación de cavidades sugiere que la IM es leve o aguda. (Figura 5)
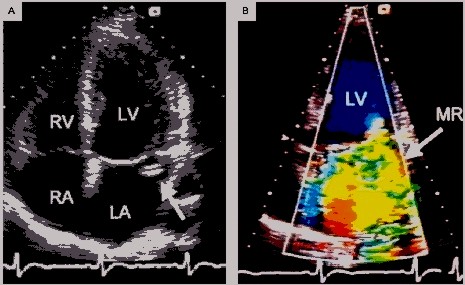
Figura 5. MCD idiopática, agrandamiento de cuatro cavidades, con severa reducción de la función VI (FE 0.22). VM anatómicamente normales.
Las
características patológicas de las válvulas responsables por la IM se hace a
menudo evidente durante el estudio ecocardiográfico y debe buscarse siempre.
Si
el eco transtorácico (ETT) falla en demostrar la patología valvular, el eco
transesofágico (ETE) puede estar indicado si se contempla la cirugía, debido a
que la información anatómica proporcionada puede ayuda al cirujano para
decidir el tipo de cirugía más conveniente.
Esto se puede lograr con la evaluación con el ETE multiplano del
movimiento de las valvas (normal, reducido, excesivo), morfología de la lesión
(prolapso/flail, redundancia, engrosamiento / calcificación, perforación,
vegetación, dilatación del anillo), y dirección del jet regurgitante
(anterior, posterior, central, medial, lateral).
Los
aspectos más importantes de la VM deben ser examinados con ETE efectuando
cuatro simples movimientos del ETE: 1.retirada/avance 2. Flexión/retroflexión,
3. ajuste del ángulo 4. rotación de la sonda.
Después
de la reparación de la válvula y retiro del bypass cardiopulmonar, una segunda
evaluación con el ETE es importante para confirmar la reparación adecuada.
Otro rol importante del ETE post-bypass es asegurarse que no exista obstrucción
al TSVI.
También
es importante determinar el mecanismo y la severidad de la IM por ecocardiografía,
dado que ciertas lesiones están asociadas con reflujo leve o severo. Por
ejemplo, la rotura de cuerdas y una valva mitral flail están inevitablemente
asociadas con IM severa, mientras que la calcificación del anillo mitral tiende
a estar asociada con insuficiencia leve a moderada.
La
ecocardiografía es la herramienta mas utilizada para estimar la severidad de la
IM. No obstante, este método es imperfecto y esta en continua evolución.
El
Doppler color en modo pulsado permite la visualización simultánea de la anatomía
y la velocidad del flujo sanguíneo en tiempo real. El flujo que se aleja del
transductor por convención, produce una imagen en azul, mientras que la sangre
que se acerca produce una imagen roja.
El
orificio mitral regurgitante en la IM severa es relativamente pequeño; el gran
flujo que atraviesa el orificio regurgitante pequeño es acelerado por el alto
gradiente entre el VI y la AI. Cuando la corriente sanguínea alcanza el lado
ventricular del orificio, el flujo se acelera y altera la sangre presente en la
AI. Este aumento en la velocidad es detectado por el Doppler.
Una
gran variedad de técnicas se han utilizado para cualificar y cuantificar la
severidad de la regurgitación en la IM.
Estas
técnicas son:
1.
Estimación visual
2.
Mapa de color
3.
Método del área de la superficie de isovelocidad proximal
4.
Doppler cuantitativo
5.
Método de la vena contracta.
La
inspección visual de la imagen de flujo color del jet de IM, es de uso moderado
para evaluar su severidad. Se puede distinguir entre IM trivial y severa. Sin
embargo la gradación entre estos dos extremos es problemática pero a menudo
importante.
Aunque
la cantidad exacta de regurgitación requerida para causar síntomas y
eventualmente deterioro de la función ventricular, no se conoce, en estudios de
pacientes sintomáticos con IM, la fracción regurgitante (FR) habitualmente
excede 0.40. De igual manera cuando la válvula mitral es reparada no reduce la
FR a < de 40%, la mejoría post-cirugía es limitada.
De
manera tal que la distinción entre regurgitación leve a moderada (FR <0.40)
y moderadamente severa (FR 0.40 a 0.60) tiene implicancias clínicas y es el
objetivo de análisis más cuantitativos de la severidad de la IM.
El
primero de los intentos de cuantificar fue el mapa de color. Esta técnica
analiza el área del jet regurgitante en la AI como un número absoluto o
normalizado por el tamaño de la AI para evaluar la severidad. Sin embargo la
imagen de flujo color es de velocidad y no del actual flujo, por lo que el mapeo
puede sobreestimar la severidad de la insuficiencia.6 Por otro lado,
si el flujo es dirigido hacia una de las paredes de la aurícula, el tamaño del
jet es limitado, y la severidad de la IM puede ser infraestimada. Los factores
de equipo también afectan el tamaño del mapa de color.
Actualmente
el mapa de color se utiliza menos que hace 5 años debido a que lleva tiempo, y
a menudo no agrega mucha información a la valoración visual de la severidad de
la IM.
Método del Area de Superficie de
Isovelocidades Proximales: (PISA)
Cuando
la sangre ingresa al orificio regurgitante desde el VI, adquiere la forma de una
semiesfera. En la parte más externa de esta zona de convergencia, la semiesfera
es mayor y la velocidad sanguínea es baja, acelerándose al estrecharse el jet.
Delimitando la hemiesfera donde el aliasing comienza, la velocidad en este punto
(limite de Nyquist) es conocida por el seteo de la maquina. Multiplicando
velocidad y área en ese lugar, el flujo regurgitante puede ser calculado. 7,
8
El
área del flujo se calcula como 2pR2,
donde el radio es la longitud de la línea desde el borde externo de
convergencia de la hemiesfera al plano de la válvula. En teoría, el PISA debería
ser un medio excelente de evaluar la severidad de la IM. Desafortunadamente,
tiene varias limitaciones.
Primero,
el método es extremadamente dependiente del contorno de convergencia elegido.
El campo alejado del orificio regurgitante puede ser hemiesferoide (oblongo) y
no hemiesférico, causando sobreestimación del área de convergencia (“r”
muy grande) y de esta manera la tasa de flujo verdadera. 9, 10 El
campo cercano al orificio regurgitante puede ser plano y puede causar
infraestimación del área de convergencia (“r” muy corto) y dar una tasa de
flujo errónea.
Segundo,
para medir el radio exactamente, se debe conocer exactamente el plano del
orificio lo que puede ser difícil de identificar.
Tercero,
solamente el flujo instantáneo se calcula por este método. No se puede asumir
que este flujo sea el mismo a través de toda la sístole, de manera tal que el
flujo regurgitante total no puede ser calculado.
De
manera alternativa, el área del orificio regurgitante, que se piensa que puede
ser anatómicamente fija, se ha utilizado como un índice de insuficiencia
(grandes orificios deberían causar mayor regurgitación). Utilizando el PISA el
flujo máximo regurgitante puede ser calculado.
El
área del orificio es obtenido como el conciente del flujo máximo regurgitante
y la velocidad máxima de IM. 11, 12 Este método ha demostrado ser
exacto utilizando el jet central. No obstante en los pacientes con PVM que
tienen flujo convergente excéntrico, el cálculo del área del orificio es
menos exacto. 13
El
PISA puede ser poco confiable para cuantificar la insuficiencia, pero la
presencia de PISA es habitualmente un indicador de IM, al menos de grado
moderado.
El
flujo Doppler cuantificado compara el flujo diastólico mitral con el VTI a
nivel de la válvula mitral x el área valvular mitral; es decir el flujo mitral
total; con el flujo aórtico anterogrado VTI sistólico a través de la válvula
aórtica x área valvular aortica. La diferencia entre flujo total - flujo anterógrado
representa la diferencia entre el volumen total
bombeado
por el VI y el VS. Esta diferencia es el volumen regurgitante (VR). Dividiendo
el VR por el volumen total del VI se obtiene la FR.
El
análisis cuantitativo del flujo Doppler puede ser el método más exacto para
evaluar la severidad de la IM, sin embargo consume tiempo y por eso no ha ganado
gran aceptación en la práctica clínica. (Fig. 6)
Figura 6. Evaluación de la severidad de la IM por el cálculo del volumen de flujo transmitral y transaórtico. El diámetro del anillo mitral y el VTI a nivel del anillo mitral se utilizan para calcular el VS total (izq.). El VS anterógrado se determina a partir del área del TSVI y del VTI a su nivel (der.).
Un método sencillo de estimar la severidad y el área del orificio de la IM es medir el ancho de la vena contracta (el tamaño del jet cuando este abandona el orificio regurgitante) cuando éste aún no se ha dispersado.
Al momento actual la estimación de la IM no ha alcanzado el grado de precisión que se obtiene en la estimación de la severidad en la estenosis mitral. Todos los métodos con excepción de la estimación visual (de por sí inexacto) requieren una cantidad sustancial de tiempo, dedicación y controles de calidad.
En general cuando exactitud y factibilidad compiten en la arena clínica, la factibilidad gana. Por ejemplo durante los últimas 3 décadas, se buscó un índice de contractilidad.
A
pesar de las investigaciones y el desarrollo de un sin número de índices
exitosos, la FE con todas sus fallas es aún por lejos el método más comúnmente
utilizado de función ventricular.
A
pesar de sus limitaciones continúa siendo el mejor índice del cardiólogo
debido a que es fácil de obtener y entender. La aceptación de cualquier método
para medir la severidad de la IM le ocurrirá lo mismo.
Es
importante recordar que los hallazgos del ecocardiograma para la IM aguda pueden
diferir significativamente de los encontrados en la IM crónica compensada.
Para
ambos tipos de pacientes el primer objetivo de la ecocardiografía es
identificar el mecanismo de la insuficiencia. En pacientes con insuficiencia crónica
significativa, se pueden buscar numerosas pistas directas e indirectas para
cuantificar la severidad. Primero, la función VI puede parecer ser hiperdinámica,
a menos que disfunción VI progresiva haya desarrollado. La AI deberá estar
agrandada, y el septum interauricular podrá desviarse hacia la AD como
resultado de la hipertensión AI, particularmente durante la sístole.
Se
utiliza solamente cuando se contempla la conducta quirúrgica. Durante el
cateterismo cardiaco, se obtienen las presiones derechas.
Una
gran onda V > 2 veces la presión media en el trazado de la presión en cuña,
es indicativa de IM severa. Sin embargo una gran onda V puede ocurrir en otras
condiciones, y por otro lado una IM severa puede estar presente en ausencia de
onda V.
Un
aumento en la presión de la arteria pulmonar es útil como factor pronóstico
negativo, pero por si solo no excluye la cirugía. Un ventriculograma se efectúa
para evaluar la severidad de la IM. Un estudio reciente estudio que utilizo ETE
no encontró ventaja para el cateterismo en la toma de decisiones. 14
La RNM es extremadamente exacta en el cálculo de los volúmenes del VI y
VD.
En
un sujeto normal, el VS de ambos ventrículos es prácticamente igual. En la IM
el VS del VI está aumentado. Calculando el VFS y el VFD de cada ventrículo, la
diferencia en VS puede ser evaluada. A su vez, el VR aproximado es la diferencia
entre el VS de VI y el VS (anterogrado) del VD.
En la IM aguda, aquí hay una disminución súbita del volumen minuto
anterogrado y un aumento súbito en la presión AI. La severidad depende del área
del orificio regurgitante. Esta situación suele requerir cirugía urgente, pero
antes es necesario estabilizar al paciente.
El
tratamiento medico y mecánico con la ayuda de contrapulsación aórtica esta
dirigido a aumentar el VM y disminuir la regurgitación, disminuyendo la
sobrecarga de volumen y la presión en la AI. Los vasodilatadores poderosos con
el nitroprusiato son efectivos en aumentar el flujo anterogrado.
En
la IM crónica, considerando que las medidas recomendadas en la IM aguda son
eficaces, es intuitivo que la terapia vasodilatadora también funcione en el IM
crónica. Sumado a hecho que un ensayo con nifedipina en pacientes asintomáticos
con insuficiencia aórtica demostró que este vasodilatador reduce la necesidad
para cirugía 63. Sin embargo no hay estudios controlados grandes que demuestren
similar beneficio en la IM.
En
el paciente sintomático con disfunción VI, la terapia con vasodilatadores es
efectiva, como en la mayoría de los pacientes con ICC. No obstante una vez que
el paciente se vuelve sintomático y manifiesta disfunción VI evidente, la
cirugía más que el tratamiento con vasodilatadores, es lo indicado.
Es
interesante que los estudios animales muestran que los b-bloqueantes son
especialmente efectivos en el tratamiento de la disfunción VI en IM
experimental.
El
paciente sintomático con IM crónica es probable que desarrolle fibrilación
auricular. Estos pacientes tienen riesgo aumentado de embolizacion sistémica.
Aunque este riesgo no parece ser tan severo como la estenosis, el riesgo es aun
significativo. En un estudio, 22% de los pacientes tuvieron embolismo. 15 Los
pacientes con PVM e IM en general están en riesgo de desarrollar endocarditis
infecciosa después de procedimientos que causan una bacteriemia. La profilaxis
estándar esta indicada.
Ejercicio
El paciente asintomático sin dilatación cardiaca o fibrilación
auricular (FA) puede efectuar ejercicio sin restricciones.
El
paciente con IM puede permanecer asintomático por muchos años; con un promedio
de tiempo desde el diagnostico hasta el comienzo de los síntomas de
aproximadamente 16 años.
Hay
pocos datos sobre la tasa de progresión de la hemodinamia en los pacientes con
insuficiencia leve a moderada, debido a que la mayoría de las series se limitan
a pacientes con insuficiencia severa. Además, los datos disponibles son difíciles
de interpretar, puesto que los criterios para evaluar la severidad de la
insuficiencia varían y no están siempre claramente definidos. Aún teniendo en
cuenta que las repercusiones clínicas dependen fuertemente de la causa de la
enfermedad, es muy frecuente que pacientes con diversos mecanismos de
insuficiencia sean incluidos en un mismo estudio.
En
los pacientes con IM severa sintomática el resultado clínico es pobre: Tasas
de supervivencia tan bajas como 33% a 8 años en ausencia de cirugía. La tasa
de mortalidad promedio es 5% por año; la mayoría de las muertes son
relacionadas a insuficiencia cardiaca, pero hay una incidencia substancial de
muerte súbita, sugiriendo que las arritmias ventriculares pueden ser una
característica importante el proceso. 16
Otras
complicaciones incluyen FA, eventos isquémicos cerebrales y endocarditis
bacteriana.
En
el paciente con PVM, el desenlace clínico depende de la extensión y severidad
de la enfermedad valvar y de la severidad de la insuficiencia. La progresión de
la enfermedad puede ser lenta e insidiosa o pude ser abrupta, como resultado de
una ruptura cordal que lleva a una válvula flail.
En un
estudio de pacientes con IM severa y asintomáticos al inicio causada por PVM,
únicamente el 28% requirieron cirugía dentro de los 5 años por desarrollo de
síntomas. 17 En contraposición, 90% de aquellos con válvula mitral
flail murieron o fueron sometidos a cirugía dentro de 10 años,
independientemente de si tenían o no síntomas al inicio.
En
última instancia la terapia definitiva para la IM severa es la corrección de
la lesión. El objetivo de la cirugía es restaurar la competencia, aliviar los
síntomas y prevenir la disfunción VI o su progresión.
El
momento de la cirugía, ahora como en el pasado, sopesa los riesgos de la
operación contra los beneficios (Fig. 7). Para la mayoría de las lesiones
valvulares, el riesgo es que en la cirugía se inserta una prótesis, la cual
presenta los riesgos inherentes como la falla, endocarditis y tromboembolismo.
Sin
embargo, actualmente y en muchos casos de IM se prefiere la reparación más que
el reemplazo, de esta manera se mejora la ecuación riesgo / beneficio de la
cirugía.
A
manera de resumen, al momento de la operación de una IM deberán balancearse,
el estado sintomático, la disfunción VI y el tipo de cirugía que se efectuará
en definitiva, todos deben ser sopesados para alcanzar la decisión de cuando
operar.
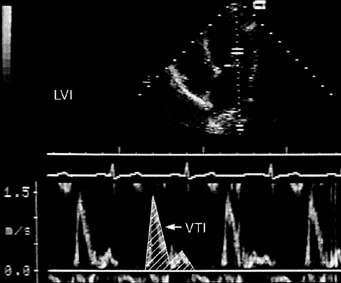
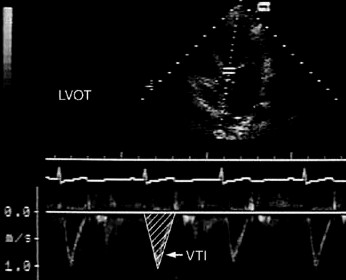
FIG. 7. Representación del concepto del tiempo optimo del reemplazo quirúrgico. La operación precoz produce baja mortalidad operatoria y preservación de la función ventricular. Sin embargo debido al riesgo operatorio limitado a las complicaciones asociadas a las prótesis (el principal determinante de la pendiente de sobrevida postoperatoria en la fase temprana de una cirugía efectuada en tiempo), el riesgo postoperatorio excede al del tratamiento médico puro en la fase temprana de la enfermedad. En contraposición, si la cirugía es tardía, la mortalidad operatoria aumenta y la función ventricular puede sufrir un deterioro progresivo después de la cirugía. Después de cirugía tardía, la sobrevida postoperatoria es determinada primariamente tanto por las complicaciones asociadas con la prótesis, como por la ICC. El tiempo óptimo de la cirugía balancea el riesgo del tratamiento medico de mantenimiento con el nuevo riesgo asociado con las complicaciones postoperatorias. Con la operación en el tiempo correcto, la mortalidad operatoria es baja, la función ventricular es casi completamente preservada, y el riesgo post operatorio es determinado, con en la cirugía precoz, predominantemente por el riesgo de las complicaciones asociadas con la prótesis
Tipos
de cirugía y su impacto sobre la función ventricular
Antes de considerar cuando operar es importe conocer las consecuencias de
las diferentes operaciones, porque esto puede hacer que la alternativa quirúrgica
sea parcialmente atractiva y puede modificar el tiempo para la cirugía.
La desventaja del reemplazo valvular estándar es la remoción del
aparato subvalvular que causa sustancial reducción de la función ventricular.
El
aparato valvular mitral tiene un rol más importante que el de solamente
prevenir la regurgitación durante la sístole. El aparato y sus anexos ayudan a
mantener la geometría natural del VI y ayudan a coordinar la contracción VI.
Independientemente del mecanismo de acción del aparato subvalvular hay
evidencias suficientes que la destrucción del mismo es deletérea (Figura 8).
En parte, debido a su destrucción cuando un reemplazo estándar se efectúa la
mortalidad operatoria es 10% a 12%, la FE ventricular disminuye en el
postoperatorio, y la sobrevida a 10 años es de solo 50-60%. 18,19
Figura 8. FE pre-operatoria (PRE) y post operatoria (POST) para pacientes sometidos a reemplazo con cuerdas tendinosas cortadas (cuadrados abiertos) o con cuerdas preservadas (círculos cerrados). El reemplazo con cuerdas abolidas resulta en disminución de la FE vs. preservación de cuerdas P < 0.05 comparando el estado PRE y POST. No se observo diferencia significativa con preservación cordal. (Rozich J. Circulation 86:1718; 1992)
Reemplazo
valvular con preservación cordal. Este procedimiento puede ser efectuado en la
mayoría d los casos cuando la válvula mitral en si misma es irreparable. En
situaciones en las cuales el cirujano no puede reconstruir la válvula para
restablece la competencia. En esta circunstancia, la continuidad de por lo menos
alguna de las cuerdas posteriores y la valva posterior puede mantenerse. Hay
evidencia que esta preservación parcial tiene impacto sobre la performance y la
mortalidad.20
Ahora es posible efectuar reemplazo VM o reparación a través de una
pequeña toracotomia derecha. Con la asistencia de video endoscopia. Este tipo
de cirugía esta en su infancia todavía comparada con las técnicas estándares.
Otra
nueva operación es la implantación de una VM homógrafa, el aparato
subvalvular se sutura al MP del receptor, no se dispone de seguimientos
prologados para este procedimiento
Paciente sintomático.
En general, la aparición de síntomas de disnea y ortopnea indican un
cambio en el estado fisiológico del paciente. En ocasiones este cambio es el de
una IM aguda o el agregado de una IM más severa en una enfermedad previamente
leve o moderada. En esta circunstancia el tratamiento médico puede permitir el
establecimiento de una compensación del VI por el desarrollo de HVI excéntrica,
después de lo cual el paciente se hace asintomático y permanece así por largo
tiempo.
Otro,
es el paciente con IM crónica severa, en el cual el comienzo de los síntomas
habitualmente representa el comienzo de la descompensación ventricular.
Es
de notar que puede ser muy difícil decidir si un paciente es sintomático o no,
debido a que los pacientes varían tanto la cantidad de ejercicio diario que
ellos efectúan y la forma en que expresan los síntomas. Esta determinación se
vuelve aún más difícil si una explicación alternativa para disnea o fatiga
coexiste con la IM, como puede ser, enfermedad pulmonar, obesidad y falta de
condición física.
La prueba de
ejercicio formal puede ser de utilidad para cuantificar la limitación del
paciente al ejercicio. Pudiendo ser útil combinar ecocardiografía con
ejercicio, pudiéndose determinar la presión de arteria pulmonar (PAP) a partir
de la insuficiencia tricuspídea por Doppler, y una elevación en la PAP puede
ser un sustituto para los síntomas.
Una
vez que el paciente desarrolla síntomas, estos pueden aliviarse por la cirugía
y esta puede detener o prevenir la progresión de la disfunción VI o aun
revertirla. 21 Hay evidencia que la sola presencia de síntomas
empeora el pronóstico independientemente de la función VI. 22 El
paciente sintomático debe siempre ser sometido a cirugía.
El argumento más fuerte para cirugía en el paciente IM asintomático
con disfunción VI es que la postergación de la misma resulta en peor pronóstico.
23
Como
ya fue detallado, las condiciones favorables de carga de la IM aumentan la
performance de la eyección. De manera tal, que el límite inferior de la FE
habitualmente se considera 0.55 ml, este numero debe ser reacomodado hacia
arriba en la IM.
Wisenbaugh
24 utilizó un punto de corte para FE normal de 0.60 ml Esto fue
apoyado por un reciente gran estudio de la Clínica Mayo en el cual hubo una
longevidad casi normal después de cirugía -de reparación o de reemplazo-
siempre y cuando la FE permaneciera >0.60 ml (Fig. 9). Sin embargo, una vez
que la FE disminuye a < 0.60, la sobrevida a largo plazo fue reducida.
Debido
a que la precarga aumentada en la IM es uno de los factores que aumentan la
performance de la eyección, la dimensión de fin de sístole, la cual es
relativamente precarga independiente, también se ha utilizado como una guía
para indicar el momento quirúrgico de IM.
Como
se muestra en la Fig. 9. la probabilidad de una evolución pobre aumenta dramáticamente
cuando las dimensiones
de fin de sístole aumentan a >45 mm. 25
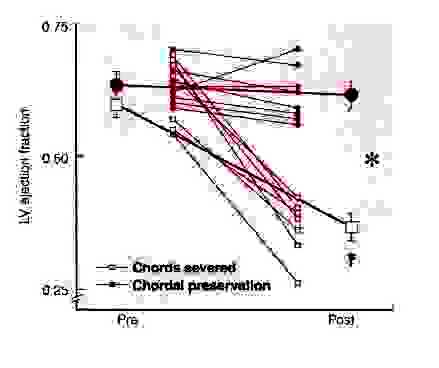
Fig. 9. Probabilidad de malos resultado operatorio para
pacientes con IM graficados contra las dimensiones de fin de sístole
pre-operatorias. Hay un brusco incremento y pobre resultados cuando los DSVI sistólicas son > 45 mm. Circulation 1994;
89: 191-7
Esto fue confirmado por Zile y cols. 26
quienes encontraron
un número virtualmente idéntico cuando un índice de DFSVI en ese estudio fue
multiplicado por la superficie corporal (BSA). Cuando el DFSVI fue convertido a
volumen y reindexado, un valor de 53 ml/m2 se encontró, prácticamente
idéntico a los 50 ml/m2 que demarcaba un buen pronóstico versus uno
malo, en el Estudio Cooperativo de Veteranos. 27 Hdochreiter y col. 28
notaron que la presencia adicional de disfunción VD causada por hipertensión
pulmonar, es un factor indicador de pronóstico negativo, también encontrado en
el Estudio Cooperativo de Veteranos.
Así, parece racional efectuar cirugía de la VM cuando la FE disminuye hacia 0.60 ml, cuando el DFSVI alcanzan los 45 mm, o cuando la hipertensión pulmonar es hallada en el exámen físico, por la interrogación Doppler de la válvula tricúspide, o cuando se manifiesta por disfunción VD.
Paciente asintomático con función VI normal.
A primera vista parece haber poca razón
para indicar cirugía en el paciente asintomático con IM severa y función VI
conservada. El paciente se siente bien.
Sin
embargo, la reparación de la válvula mitral en esta situación puede ser
comparada con la estrategia que se utiliza en el manejo de la comunicación
interauricular (CIA). La CIA se repara en el paciente asintomático. La operación
se efectúa con baja mortalidad, previene complicaciones y no involucra el uso
de prótesis tal es así que no se requiere anticoagulación. Cuando la reparación
puede efectuarse en el manejo de IM esto se parece a la situación de la CIA. La
mortalidad operatoria es 1% a 2%, las complicaciones posteriores de disfunción
del VI son prevenidas y no se utiliza un artificio protésico.
Para
recomendar cirugía en un paciente totalmente asintomático con función
ventricular normal es crucial efectuar reparación valvular y no reemplazo
valvular, de otra manera esta estrategia no debería utilizarse.
El
uso de “sustitutos de síntomas” en los pacientes asintomáticos para
determinar la indicación para cirugía es intrigante, pero esta estrategia no
ha sido probada prospectivamente. Hallazgos de la historia clinica y ecocardiográficos,
tales como la presencia de FA, agrandamiento significativo de la AI, dimensiones
aumentadas del VI y presiones pulmonares elevadas, pueden ser utilizadas para
identificar candidatos para esta estrategia.
La decisión de operar a un paciente con IM asintomático deberá solamente ser hecha si hay una alta probabilidad de lograr una reparación exitosa y duradera. La ecocardiografía transtorácica y transesofágica son habitualmente altamente confiables en confirmar la presencia de una valva posterior flail, que generalmente puede ser reparada con una alta tasa de éxito por un cirujano experimentado en estas técnicas.
A
diferencia del paciente con estenosis aórtica, parecería haber un curso menos
favorable en la cirugía de la VM en el paciente mayor de 75 años. Mientras que
al paciente con síntomas avanzados no se le debería negar la cirugía basado
en la edad, parece desaconsejable ofrecer cirugía al anciano asintomático. En
estos pacientes, si presentan enfermedad coronaria y un reemplazo mitral es
efectuado, se espera que dos tercios de los pacientes probablemente mueran
dentro de 5 años.
Además
la mortalidad operatoria en estos pacientes fue del 30% en un estudio reciente. 29
De modo tal que la cirugía solo debería ser ofrecida a un paciente anciano en
buen estado, claramente sintomático y en el que ha fracasado una terapéutica médica
completa con dosis óptimas.
El
pronóstico de los pacientes con IM isquémica tratados médica o quirúrgicamente
es considerablemente peor que en la IM aislada.
El
pobre pronóstico puede deberse a
1.
La
presencia de una segunda enfermedad cardiaca coronaria que continua progresando
a pesar de la intervención efectuada sobre la VM,
2.
La
presencia de disfunción VI causada por IAM que genero la IM
3.
Dificultad
en reparar tales válvulas, que necesitan reemplazarse.
En
la actualidad la mortalidad operatoria para IM isquémica es de 10% y la
sobrevida a 5 años es solamente el 50%. Hay varios mecanismos responsables por
la IM isquémica. La rotura de MP es la más común y requiere cirugía
inmediata para sobrevivir. El mecanismo más común de IM es el cierre
incompleto de las valvas, que se encuentra asociada con enfermedad multivaso y a
una disminución significativa de la función del VI. Hay también un grupo de
pacientes con IM severa asociado con IAM inferior; aquí el mecanismo de la
insuficiencia es menos claro, pero puede estar relaciona a la dilatación del
anillo y a mal alineamiento del MP y las valvas.
En la medida que la cardiopatía isquémica, la miocardiopatia dilatada o
las enfermedades que lesiona el VI progresan, el rendimiento de la eyección
disminuye y la dilatación ventricular empeora. En la medida que ocurren estos
procesos se produce IM. La IM desmejora aún más la eficiencia del VI por la
regurgitación del ya limitado VS y al mismo tiempo, impone una sobrecarga de
volumen adicional al miocardio. En la mayoría de los casos, la enfermedad
cardiaca primaria no puede ser tratada directamente (Ej. MCD). No obstante
recientemente a habido interés en tratar la IM secundaria con la esperanza de
mejorar los síntomas y el pronóstico.
Bach
y Bolling 30 efectuaron un método quirúrgico para este problema. A
pacientes con FE promedio de 0.20 ml, una anuloplastia con anillo que redujo
sustancialmente la IM después de la cirugía. No hubo muerte operatoria y la
sobrevida a 1 año fue del 70%. Al mismo tiempo, el VFD había disminuído de
276 ± 78 ml/m2 a 215 ± 80 ml/m2, y la FE se incrementó
a 0.26 ml. Estos resultados son alentadores y sugieren que esta estrategia es
posible.
El Colegio
Americano de Cardiología (ACC), la Asociación Americana de Cardiología (AHA)
y la Sociedad de Cardiología Americana (SCA); han desarrollado guías
detalladas para la evaluación, seguimiento y sobre el tiempo óptimo para la
intervención quirúrgica de los pacientes con IM severa.
Los
candidatos para la cirugía son aquellos con síntomas, excepto con disfunción
VI severa, y los pacientes sin síntomas que tienen disfunción VI leve a
moderada. La cirugía esta indicada en el paciente asintomático con función VI
conservada, si hay una alta probabilidad de reparación valvular o si hay
evidencias de hipertensión pulmonar o fibrilación auricular reciente.
Estas
guías también dan directivas para el uso de la ecocardiografía, la prevención
de la fiebre reumática, la endocarditis y las indicaciones para anticoagulación.
31
Los
algorritmos de manejo en la IM crónica y severa, y las fórmulas de PISA
modificadas; se incluyen en los anexos al final de este trabajo.
Tabla 2 Recomendaciones para la frecuencia del estudio ecocardiográfico en pacientes con IM crónica y enfermedad mitral primaria.
|
Severidad e la IM |
Función
VI
|
Frecuencia
de la Eco
|
|
Leve |
Normal
DSVI y FE |
Cada 5 años |
|
Moderada |
Normal
DSVI y FE |
Cada 1-2 años |
|
Moderada |
DSVI >
40mm o FE < 65 |
Anual |
|
Severa |
Normal
DSVI y FE |
Anual |
|
Severa |
DSVI >
40mm o Fe <65 |
Cada 6
meses |
DSVI diámetro fin sístole
VI, FE fracción eyección. Otto CM. Evaluation
and management of chronic mitral regurgitation. N Eng J Med 2001; 345: 740-46
En el paciente con soplo, el umbral para evaluación con ecocardiografía
deberá ser bajo.
Cuando
la válvula es anatómicamente anormal, el seguimiento periódico, clínico y
ecocardiográfico permitirán la identificación precoz de síntomas,
complicaciones y disfunción sistólica. En los pacientes con IM secundaria, la
ecocardiografía sirve como el primer paso hacia la evaluación del tratamiento
del proceso patológico subyacente. La intervención quirúrgica en los
pacientes con IM severa es indicada por el comienzo de los síntomas o en la
presencia de evidencias convincentes de disfunción VI. La reparación valvular,
antes que el reemplazo debe efectuarse cuando es posible.
Debemos
ser muy cautos en recomendar cirugía para un paciente asintomático,
considerado portador de IM severa pero que no tiene evidencias de anormalidades
hemodinámicas.
1.
Otto CM, Evaluation and management of chronic mitral regurgitation. N
Engl J Med.2001;345:740-46.
2.
Corin WJ,
Monrad ES, Murakami T, et al. The relationship of afterload to ejection performance in chroonic mitral
regurgitation. Circulation 1987;76:59-67.
3.
Tsutsui H, Sinale FG, Nagatsu M, et al. Effects of crónic b-adrenergic
blockade on teh left ventricular and cardiocyte abnormalities of chronci canine
mitral regurgitation. J Clin Invest 1994;93:2639-48.
4.
Zile MR, Tomita M, Ishihara K, et al. Changes in diastolic
function during development and correction of chronic LV volume overload
produced by mitral regurgitation. Circulation
1993;87:1378-88.
5.
Corin WJ,
Murakami T, Monrad ES, et al. Left ventriuclar passive diastolic properties in chornic mitral
regurgitation. Circulation 1991; 83:797-807.
6.
Shah PM Quantitativeassesssment of mitral regurgitation. J Am Coll
Cardiol 1989;13:591-3.
7.
Simpson IA,
Veldes-Cruz LM, Yoganathan AP, et al. Spatial velocity distribution and acceleration in
serial subvalve túnel and valvular obstructions: an in vitgro study using
Doppler color flow mapping. Jam Coll Cardiol 1989;13:241-8.
8.
Enriquez-Sarano
M, Miller FA Jr, Hayes SN, et al. Effective mitral regurgitant orifece area: clinical use
and pitfalls of the proximal isovelocity surface area meted. J Am Coll Cardiol
1995;25:703-9.
9.
Simpson IA, Shiota T, Gharib M, et al. Current status of flow
convergence for clinical applications: is it a leaning tower of “PISA”? J Am
Coll Cardiol 1996;27:504-10.
10.
Weintraub R, Shandas R, Crannney G, et al. Comparison of flow
convergencie (FC) calculations using color Dopppler flow mapping (CD) an phase
velocity encoded MRI: an in vitro study[abstract]. Circulation 1991;84 Suppl
II:II-636.
11.
Vandervoort PM, Rivera JM, Mele D, et al. Application of color Doppler
foow mapping to calculate effective regurgtant orifice area: an in vitro study
and initial cliinical observations. Circulation
1993;88:1150-6.
12.
Enriquez-Sarano EM, Seward JB, Bailey KR, et al. Effective
regurgitant orifice area: a noninvasive Doppler development of an old
hemodynamic concept. J Am Coll Cardiol 1994;23:443-51.
13.
Pu M,
Vandervoort PM, Griffin BP, et al. Quantification of mitral regurgitation by the proximal
convergence meted using transesophageal echocardiografphy: clinical validation
of a geometric correction for proximal flow constraint. Circulation
1995;92:2169-77.
14.
Tribouilloy
C, Shen WF, Leborgne L, et al. Comparative value of Dopplr echocardiography and
cardiac catheterization for management decision making in patients with
left-sided valvular regurgitation. Eur Heart J 1996;17:272-80.
15.
Culshed N, Epstein EJ, McKendrick Cs, et al. Systemic embolism in mitral
valve disease. Br Heart J 1970;32:26-34.
16.
Gigioni
F, Enriquez-Sarano M, Ling LH, et al. Suden death in mitral regurgitation due to flail
leaflet. J Am Coll Cardiol 1999;34:2078-85.
17.
Rosen SE,
Borrer JS, Hochreiter C, et al. Natural history of the asymptomatic/minimally
symptomatic patient with severer mitral regurgitation secondary to mitral valve
prolapse and normal right an left ventricular performance. Am J Cardiol
1994;74:374-80.
18.
Cosgrove DM, Chavez AM, Lytle BW, et al. Results of mitral valve
reconstruction. Circulation 1986:74:I82-7.
19.
Lindblom
D, Lindblom U, Qvist J, et al. Long-term relative survival rates after Herat valve
replacement. J Am Coll Cardiol 1990;14:566-73.
20.
Cohn LH. Surgery for mitrla regurgitation. JAMA 1988;260:2883-7.
21.
Starling MR. Effects of valve surgerty on left ventricular contractile
function in patintes with long-terms mitral regurgitation. Circulation 1995;92:811-8.
22.
Ling LH, Enriquez-Sarano M, Seward JB, et al. Clinical
outcme of mitral regurgitation due to flail leaflet. N Engl J Med
1996;335:1417-23.
23.
Carabello
BA, Nolan SP, McGuire LB. Assessment of preoperative left ventricular function in
patients with mitral regurgitation: value of the end-systolic wall
stress/end-systolic volume ratio. Circulation 1981;64:1212-7.
24.
Wisenbaugh T. Does normal pump function belie muscle dysfunction in
patients with chronic severe mitral regurgitation? Circulation 1988;77:515-25.
25.
Wisenbaug T, Skudicky D, Sareli P. Prediction of otucome after valve
replacemetn for rheumatic mitral regurgitation in the era of chordal
preservation. Circulation 1994;89:191-7.
26.
Zile MR, Gaasch WH, Carrol JD, et al. Chornic mitral regurgitation:
predictive value of preopertive ecocardiographic indexes of left ventricular
function and wall stress. J Am Coll Cariol 1984;3(2,Pt 1):235-42.
27.
Crawford
MH, Souchek J, Oprima CA, et al. Determiants of suvival and left ventricular performance
after mitral valve repalcement: Department of Vetrans Affairs cooperative study
an valvular heart disease. Circulation 1990;81:1173-81.
28.
Hochreiter C, Niles N, Devereux RB, et al. Mitral regurgitation:
relationship of nonivsive descriptors of right and left ventricular performance
to clinical and hemodynamic findings and to prognosis in meidcally and
surgically treated patients. Circulation
1986;73:900-2.
29.
Enriquez-Sarano
M, Schaf HV, Orszulak TA, et al. Valve repair improves teh outcome of surgery for mitral
regurgitation: a multivariate análysis. Circulation 1995;91:1022-8.
30.
Bach S, Bolling SF. Inprovement following corrections of secondary mitral
regurgitatio in en-stage cardiomyopathy with mitral annuloplasty. Am J Cardiol
1996;78:966-9.
31.
ACC/AHA guidelines for the management of patients with valvular heart
disease: a report of the American College of Cardiology/American Heart
Association Task Force on Practice Guidelines (Committee on Management of
Patients with Valvular Heart Disease). J Am Coll Cardiol 1998; 32:1486-588.
Anexo I.
Figura 10. Manejo de la
IM crónica severa, modificado de las guías del ACC-AHA. 18
Anexo II
Figura 11. Bonow y col. ACC/AHA Task Force Report JACC 32;1998:1486-1588.
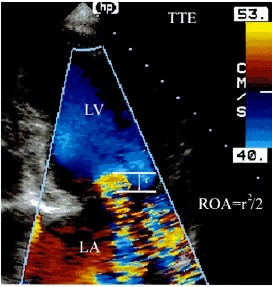
Anexo III
FORMULAS DE PISA SIMPLIFICADAS
1.)
|
r2/2 |
IMAGEN IM13
Figura 1.
Medición del radio del flujo de convergencia proximal con el uso del método de
convergencia de flujo simplificada con ETT (TTE eco-transtorácico; LV, ventrículo
izquierdo; IA, aurícula izquierda; ROA, area del orificio regurgitante
Esta formula
asume una diferencia de la presión entre el ventrículo izquierdo y la aurícula
izquierda de aproximadamente 100 milímetros de Hg (velocidad del chorro [ vp ]
500 cm/s) y fijando la velocidad del aliasing del color (VA) a 40 cm/s, se
simplifica la fórmula convencional del método de la convergencia proximal (ROA
= 2pr2va/vp) a r2/2, donde r es el radio de la Semiesfera de la convergencia
isovelocidad próximal. Para 57 pacientes ambulatorios con un amplio rango de IM
[ y - x ] = -0,002 ± 0.08cm2). Esta fórmula simplificada de convergencia próximal
da una estimación exacta de ROA para una amplia gama de severidad de
regurgitación, mientras que el tiempo requerido para esta medición es acortado
por la mitad (± 1,5 0,5 minutos contra los ± 3,2 0,7 minutos). Esto puede
aumentar la frecuencia de calcular ROA en el laboratorio clínico.
Pu M, Prior DL, Fan X,
Asher CR, et al. Calculation of mitral regurgitant orifice area with use of a
simplified proximal convergence meted: Initial clinical application. J Am Soc
Echocardiogr.2001;14:180-5.
2.)
|
RSV = 100 x R2 |
PU y col.
han informan el uso de una fórmula simplificada de PISA derivada del ETE para
derivar el volumen regurgitante en 47 pacientes. A velocidades de aliasing de 42
a 60 cm/s, su fórmula simplificado, RSV = 100 x R2, donde RSV es volumen
regurgitante, y R es el radio del primer aliasing de PISA, mostró una correlación
excelente con el fórmula de PISA tradicional de un simple-radio (r = 0,98, P
< 001.RSV = 1,11± 7,3 ml) y con un método de Doppler-thermodilution (r =
0,94, P < 001.rsv = 3,2 el ± 11,9 mL)..
Pu M,
Vandervoort PM, Griffin BP, Stewart WJ, Cosgrove DM, Thomas JD. A new simplified method to estimate mitral regurgitation by the proximal
convergence method: transesophageal echocardiographic study [abstract]. J Am Soc
Echocardiogr 1995;8:351.
3.)
|
E-RVol
= PISA (Rflow)/3.25
|
Rossi y col.
mostraron en un estudio clínico que la regurgitación mitral se podía estimar
exactamente y rápidamente con una fórmula modificado de PISA: E-RVol = PISA
(Rflow)/3.25), donde E-Rvol es el RV estimado, y PISA (Rflow es el flujo
regurgitante calculado por PISA 6.28 x r2 x Vr, donde r es el radio de la
semiesfera de isovelocidad y Vr es la velocidad de aliasing seleccionada ). El
volumen Regurgitante estimado con esta fórmula fue correlacionado fuertemente
con el RV calculado por la ecocardiografia / Doppler VTI método (r = 0,96;
error estándar de la estimación [ SEE ] = 11 ml; P < 0001) y por
ecocardiografía cuantitativa (r = 0,97; SEE = 11 ml; P < 0001).
Rossi
A, Dujardin KS, Bailey KR, Seward JB, Enriquez-Sarano M. Rapid estimation of
regurgitant volume by the proximal isovelocity surface area method in mitral
regurgitation: can continuous-wave Doppler echocardiography be omitted?
J Am Soc Echocardiogr 1998;11:138-48.
4.)
|
RV
(ml) = 37 x R2 |
Gardin y
col. señalaron en un estudio preliminar que la ecuación para la regurgitación
mitral se podría simplificar a RV (ml) = 37 x R2, donde R es el
radio PISA de la interfaz rojo-azul (en centímetros), con una velocidad del
aliasing de 20 cm/s. La constante 0,3, derivada de la relación del VTI con la
velocidad máxima del chorro regurgitante mitral medido del Doppler de la onda
continua, también fue utilizada para llegar a la constante 37.
Gardin JM, Yamachika S, Utsunomiya T, Ogata T, Reid CL.Proximal
isovelocity surface area method for estimating regurgitant stroke volume in
mitral regurgitation: a simplified approach
[abstract]. J Am Soc Echocardiogr 1996;9:405.
5.)
|
RV
[mL] = 10 x R [mm] – 30 |
Con un
velocidad de aliasing (AV) de 21 cm/s, El volumen regurgitante (RV) estimado por
una formula de PISA simplificada (RV [mL] = 10 x R [mm] – 30) tenía una
exactitud de 3.3 ± 6.3 mL versus
–20.3 ±
8.7 mL para la formula standard.
Takashi Tokushima, MD,
Cheryl L. Reid, MD, Akihiro Hata, MD, and Julius M. Gardin, MD, Simple method
for estimating regurgitant volume with use of a single radius for measuring
Proximal Isovelocity Surface Area:An in vitro study of simulated mitral
regurgitation. J Am Soc Echocardiogr 2001;14:104-13.