CARDIOPATIA CONGENITA: “ANOMALIA DE EBSTEIN” EN EL ADULTO
Servicio de Cardiología. Laboratorio de Ecocardiografía Doppler.
Hospital "Angela Iglesia de Llano". Ayacucho 3288. Corrientes, capital. Argentina.
Correo electrónico: jgomez@med.unne.edu.ar
Dr. Eduardo L. Rodríguez
Hospital Ricardo Billinghurst
Ituzaingó, Corrientes, Argentina.
Correo electrónico: erodriguez@arnet.com.ar
INTRODUCCION
La anomalía de Ebstein (AE) fue descripta primeramente por Wilhelm Ebstein en 1866 y se diagnosticó sobre la base del desplazamiento dentro del ventrículo derecho (VD) del adosamiento de una valva septal rudimentaria y un abombamiento de las valvas anterior y posterior de la tricúspide; asociado a la ausencia de válvula de Thebesio y un foramen oval permeable.
Sus originales hallazgos, desplazamiento valvar y displasia valvar; posteriormente constituyeron un amplio espectro de la AE.
Es una malformación rara que tiene una prevalencia del 0.03 al 0.6 % del total de cardiopatías congénitas (CC), representando el 40% de las malformaciones congénitas de la válvula tricúspide; con una incidencia 1:20.000 nacidos vivos.
La descripción ecocardiográfica bidimensional inicial de la AE, hecha por Tajik y Lundstrom en 1973, relegó al cateterismo invasivo para casos de AE muy complejos
La presente revisión sistemática de la AE en el adulto y con especial énfasis en la embarazada, tiene los siguientes objetivos:
1. Describir los hallazgos anátomo-clínicos y ecocardiográficos en la AE
2. Evaluar el riesgo cardiovascular prequirúrgico en la mujer embarazada con AE.
3. Analizar las técnicas de estudio y de tratamientos más adecuados en el adulto.
DEFINICION DE AE: 1
Es un espectro de anomalías congénitas que afectan al aparato valvular tricuspídeo. Consiste en el adosamiento anormal de las valvas tricuspídeas posterior y frecuentemente la septal, con redundancia y fenestración de la valva anterior y un anillo aurículo-ventricular (AV) tricuspídeo descendido y dilatado, hacia el miocardio subyacente ventricular derecho (VD). Como consecuencia de esta inserción anormal parte de la porción de entrada del VD pertenece a la aurícula derecha.
CONSIDERACIONES EMBRIOLOGICAS Y ANATOMICAS DE LA VALVULA TRICUSPIDE: 2
En el estadío posasa temprana los cojines lateral izquierdo, derecho, inferior y superior del canal AV aparecen dentro de sus orificios. Simultáneamente aparecen las crestas conales sinistro-ventral y dextro-dorsal y las paredes ventriculares, todas participan en el desarrollo embriológico de las valvas AV.
Las valvas tricuspídeas son tres: Anterior, septal e inferior. La valva posterior se origina del cojín lateral derecho, la valva septal del cojín inferior. La valva anterolateral tiene origen dual: la porcion medial (septal) se origina de la cresta conal dextro dorsal y la porcion lateral del cojín lateral derecho. El tejido valvar inicialmente es muscular y por diferenciación celular se transforma en tejido conectivo, mientras que las cuerdas tendinosas y los músculos papilares se desarrollan a través de un proceso de diverticulización y socavación de las paredes ventriculares. Cualquier anormalidad en el proceso de desarrollo los cojines inferior y lateral derecho del canal AV y de la cresta conal dextro dorsal, así como cualquier falla en el proceso de diverticulización y socavación de las paredes ventriculares, resultará en un desarrollo anormal del aparato valvular tricuspídeo.
Factores pronósticos durante la vida fetal:
Durante el período perinatal la AE tiene un pronóstico muy pobre, presentando una tasa de mortalidad total del 85%. Los criterios ecocardiográficos utilizados para evaluar la severidad de la AE durante la vida intrauterina son los mismos que los utilizados después del nacimiento. 3-5
La AE puede ser fácilmente reconocida en el período intrauterino, pero las características hemodinámicas de la AE deben definirse para ayudar a predecir las chances de supervivencias en el período posnatal inmediato.
Con este objetivo 5 se estudiaron retrospectivamente las características fetales de ocho videocasos de en fetos.
Así, se encontró que los siguientes índices no tenían significancia pronóstica sobre el resultado del neonato o del feto:
1. La relación de apertura de la tricúspide sobre el diámetro del anillo.
2. El grado de desplazamiento de la válvula tricúspide abierta.
3. El grado de insuficiencia tricuspídea (IT).
4. [(Superficie de AD + VD atrializado) / (VD funcional + AI + VI)].
5. La relación cardiotorácica > 0.65. (ICT)
Se efectuó un análisis estadístico con t-test no pareado y chi cuadrado para variables discretas. Se aplicó un store “z” basado sobre datos normales y fue calculado para el gasto sistólico ventricular izquierdo (VI).
Se observó una correlación linear positiva entre el store “z” del gasto VI y el tamaño de la fosa oval en los casos asociados (r = 0.81, p < 0.05)
Concluyen que el pronóstico de la AE durante la vida fetal no está influenciado por los criterios ecocardiográficos descriptos en la vida posnatal y que podrían estar relacionados a factores que controlan la carga de volumen del VI.
FISIOPATOLOGIA EN AE:
Las alteraciones fisiopatológicas dependen de:
1. Grado de disfunción valvular tricuspídeo: En el neonato la hipertensión pulmonar (HTP) debe involucionar en las primeras horas pero mientras persista algún grado de HTP, agrava la IT con desarrollo de insuficiencia cardíaca (IC) derecha, a menos que normalize las resistencias pulmonares. Puede haber cianosis, persistente o intermitente, debido a una comunicación interauricular (CIA) o un foramen oval permeable (FOP), que puede agravarse por la presencia frecuente de un síndrome de Wolff-Parkinson-White (WPW)
2. Tamaño de la porción atrializada del VD: La porción atrializada actúa como un aneurisma con comportamiento paradojal (fenómeno de vaivén), que se distiende en sístole atrial haciendo disminuir el gasto VD.
3. Capacidad de bomba de cámaras ventriculares: LA AE presenta un peor pronóstico con menores índices sistólicos.
4. Anatomía del tabique interatrial: Peor pronóstico cuando la relación entre la CIA y la longitud del septum interauricular (SIA) es > 0.16 (CIA/SIA > 0.16).
CLINICA DE LA AE EN EL ADULTO:
Fisiopatología clínica: 6
El primer ruido cardíaco está disminuido: Podría ser por un BAV, bajo flujo izquierdo y ocultamiento del componente mitral por agrandamiento de la AD y rotación cardíaca por alteración valvular. También puede presentase aumentado y retardado por alteración valvular, con intenso ruido en valva anterior, semejante a un click eyectivo (valva deformada y móvil).
Soplo sistólico: La IT da un soplo proto-mesosistólico, decreciente en región paraesternal izquierda baja, que puede ser holosistólico. La IT no está acompañada de HTP con lo que el gradiente ventrículo arterial se agota rápidamente. Tampoco aumenta con la inspiración debido a que el VD no admite llenados importantes. Podría ser que el soplo de IT se origine por turbulencia impuesta por la contracción en la zona atrializada del VD.
El segundo ruido presenta variaciones: normal o desdoblado fisiológico, indica flujo pulmonar aceptable.
R2 único y formado por el componente aórtico: Flujo pulmonar disminuído con desaparición del componente pulmonar.
Desdoblado ampliamente con variación respiratoria o no: Retardo del componente pulmonar del R2 por presencia de BCRD.
Desdoblamiento inverso del R2 con comportamiento respiratorio paradójico: se produce por un WPW.
Ruidos diastólicos: Es común en la AE, semejante a la existencia de múltiples frotes pericárdicos. Puede ser protodiastólico atribuible a un chasquido de apertura tricuspídea debido a un llenado VD rápido con mala distensibilidad o cierre retardado de la válvula pulmonar. También es audible un R3 por un VD poco complaciente que recibe un flujo aumentado para su poca capacidad. Se puede auscultar un R4 derecho por contracción enérgica de la AD por hiperflujo contra la resistencia de un VD pequeño. Si hay BAV el R4 continúa y se suma al R3, esta suma origina soplo meso y telediastólicos.
Semiología clínica:
Un estudio de 67 pacientes con AE (12 años de seguimiento medio) demostró que los predictores de mortalidad fueron: 7
1. Incapacidad funcional NYHA clase III
2. Relación cardiotorácica > 0.65
3. Desaturación de O2 en sangre arterial < 90%
4. Diagnóstico en la infancia.
Pueden presentar disnea, palpitaciones, cianosis, dedos en palillo de tambor en presencia de cortocircuito de derecha a izquierda.
Puede haber un matiz violáceo en la piel de la zona malar, posterior de los brazos y latero-dorsales; debido a bajo gasto cardiaco aún en ausencia de shunt de derecha a izquierda.
Los pulsos venosos pueden ser normales, aún en presencia de IT.
Electrocardiograma:
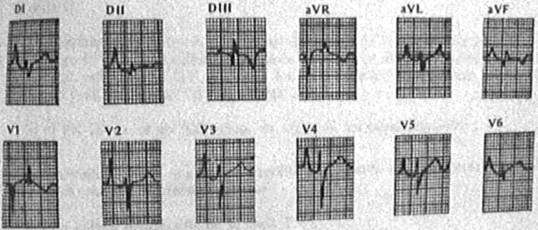
Puede presentar hipertrofia AD y sobrecarga auricular derecha, (la AE es una de las causas de auriculo-megalia más grande), PR prolongado con bloqueo aurículo-ventricular (A-V), Bloqueo completo de rama derecha o izquierda. (Fig. 1)

Fig. 1: Electrocardiograma de con AE con sobrecarga de volumen y presiones derechas. Se observan ondas “P” picudas (de Taussig) debido a la sobrecarga de AD con escasa progresión de ondas R en precordiales. No se observa delta de preexcitación ventricular.
El Síndrome WPW y la taquicardia AV paroxística reentrante puede observarse en 10-23% de los casos y la vía accesoria se encuentra alrededor del orificio de la valva tricúspide malformada.
También puede existir bajo voltaje de QRS en precordiales derechas. Algunos pacientes requieren estudio de mapeo electrofisiológico para resolver el WPW con ablación con catéter con radiofrecuencia (Fig. 2). Las vías accesorias musculares son frecuentes en un mismo paciente y se creen que son causadas por defecto en la formación de tejido de insulación en la unión AV.
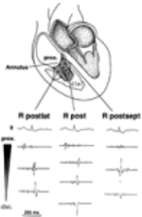
Fig. 2: Electrogramas locales preablación de un paciente con AE, ritmo sinusal y manifestación de un haz accesorio postero septal derecho
Ho y cols. 8 han revisado la estructura macro y microscópica de 5 especimenes de corazón representando el espectro de malformaciones de Ebstein con el objetivo de describir la unión AV derecha para identificar potenciales sustratos para trastornos de la conducción. En la unión parietal derecha hallaron dos conexiones AV accesorias musculares en 4 corazones. Un plano de tejido fibro-graso separaba el miocardio ventricular del auricular en la unión AV derecha de todos los corazones.
El nodo AV compacto estuvo se encontraba más cerca del seno coronario, que lo habitual.
Las conexiones AV accesorias estuvieron presentes en 4 corazones, que en uno se halló una conexión AV accesoria fascículo ventricular. La hemirama derecha estaba hipoplásica o ausente en 4 corazones. LA unión AV se encontraba mejor desarrollada de lo que se pensaba, aunque con anormalidades estructurales que deben tenerse en cuenta en las arritmias de la AE. (Fig. 3)
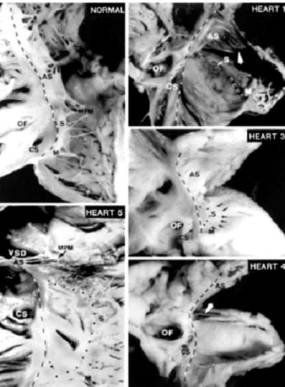
Fig. 3: Unión AV normal y cuatro corazones con AE. El triángulo de Koch está formado por el borde septal de la unión AV y valva septal de Eustaquio. El desplazamiento de la valva septal y valva parietal son marcadas por línea punteada.
La valva antero-superior (corazón 1) está adosada distalmente (flecha).
En el corazón 3 la valva septal está indicada por pequeñas flechas.
En el corazón 4 las valvas septal y parietal no están formadas, las flechas indican el orificio antes que el espécimen fuera cortado. El corazón 5 muestra una CIV perimembranosa (VSD) y un delgado músculo papilar medial (MPM). CS: seno coronario, OF: Fosa oval
Tele-radiografía de Tórax de frente:
En el adulto con AE y función VI conservada suele presentarse con diferentes grados de cardiomegalia a expensas del borde derecho de la silueta cardíaca. No así ante la presencia de IC, IT severa, cianosis o arritmia supraventricular significativa que puede acompañarse de claros signos congestivos hilares y con derrame pleural (Fig. 4)
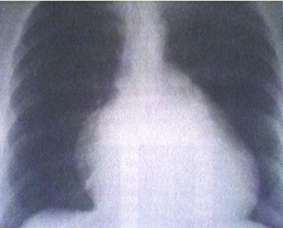
Fig. 4: Rx tórax de frente en mujer con AE. Aurículo megalia derecha y desplazamiento del tronco pulmonar hacia la izquierda
DESCRIPCION DEL ECOCARDIOGRAMA Y DEL DOPPLER EN LA AE: 2
En casi todos los casos la AE se presenta en situs solitus, concordancia AV y concordancia VA con los grandes vasos normalmente relacionados. El aparato valvular entero es displásico, considerado por algunos como parte de a anomalía. El anillo valvular tricuspídeo casi siempre dilatado y el grado de desplazamiento valvar, variable, siempre es mínimo en la valva posterior. La valva antero-superior es normal.
En la forma severa, que más frecuente, la posterior está aplicada a la pared ventricular y existe una valva septal rudimentaria. Ambas pueden presentar diferentes grados de displasia con engrosamiento y bordes enrollados.
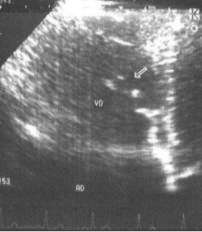
Fig. 5: ECO bidimensional con una vista coronal de 4 cámaras apical con focalización en válvula tricúspide. VD atrializado y de volumen funcional reducido. Valva septal elongada y largamente adosada al septum interventricular (flecha)
En una vista eje largo paraesternal izquierdo con inclinación al inlet VD, eje corto transversal, apical coronal de 4 cámaras apical y subcostal, evalúa claramente la anatomía de la AE.
Se observa una mega aurícula derecha, que en realidad se trata de un VD atrializado y la valva septal tricúspide elongada, largamente adosada al SIV con desplazamiento de > 8 mm/m2 (> 20 mm desde su origen). (Fig. 5)
La valva anterior aparece como navegando adosada al anillo tricuspídeo y unida a la pared ventricular por cuerdas tendinosas y músculo papilar anormales. Puede estar fenestrada y causar diferentes grados de obstrucción al tracto de entrada VD o TSVD, inclusive unirse a las valvas septal o posterior simulando una estructura Hammock. El desplazamiento valvar alcanza la unión del inlet con la porcion trabecular del VD.
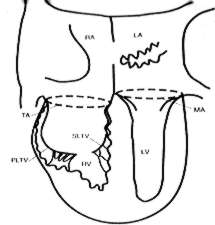
Fig. 6: Diagrama esquemático de la AE. (Valdes-Cruz LM, Cayré RO. Anomalíes of the tricuspid valve and rigth atrium. En: Valdes-Cruz LM, Cayré RO, ed. Echocardiographic diagnosis of congenital heart disease. An embryologic and anatomic approach. Philadelphia, PA: Lippincott-Raven Publishers, 1999: 237-242.)
La porción proximal del VD atrializada (inlet del VD) está dilatada o aneurismática, con paredes adelgazadas y fibras musculares reducidas o aún ausentes. El endocardio está engrosado, fibroso y es suave. La porción distal o funcional del VD es delgada y está dilatada en el 66 % de los casos de AE. Un 10% de las AE son imperforadas con una división muscular entre el inlet y la porción trabeculada del VD y un orificio tricuspídeo con tejido valvular remanente o ausente. Existe entre un 65% y 93% de casos asociado a CIA tipo foramen oval o CIA tipo OS.
El principal criterio ecocardiográfico para evaluación de la válvula tricúspide con vista a reparación o reemplazo valvular, es la presencia de una valva anterior móvil, de buen tamaño que puede ser modificada en una válvula unicúspide. De ser necesario se puede realizar plicatura del anillo y de la cámara atrializada. El tironeamiento de la valva anterior hacia las paredes ventriculares y hacia la porcion atrializada, no contráctil dilatada del VD son características desfavorables para reparación y sugieren reemplazo valvular tricuspídeo.
Cuando el ETT no es satisfactorio se debe recurrir al ETE para obtener los detalles anatómicos más críticos.
El Doppler color evalúa la severidad de la IT y la presencia de defecto septal inter-auricular tipo (Ostium secundum o FOP). Debido a la presencia de fenestraciones en la valva anterior se puede observar más de un jet tricuspídeo regurgitante
Se pueden calcular las velocidades y gradientes de AD, CIA, VD y en arteria pulmonar. Con el color se evalúa la presencia de defectos interauriculares con cortocircuito derecha a izquierda, aunque puede existir un canal AV parcial, ductus, estenosis pulmonar, atresia pulmonar, estenosis aortica, atresia tricuspídea, bicúspide aórtica o bicúspide pulmonar, vena cava superior izquierda persistente, coartación de aorta, cor triatriatum derecho o conexión venosa pulmonar anómala parcial.
Para las mediciones Doppler de las presiones en cavidades derechas se debe tener en cuenta una vista apical cuatro cámaras o subcostal: 9
1. Estimación de la presión AD = Diámetro máximo y mínimo de la vena cava inferior. Si en inspiración es < 50%, significa aumentada 6-10 mmHg.
2. Presión sistólica del VD = Presión en AD + (se asume 5 mmHg. en niños y 10 mmHg, en adultos) 4x V2 (de la velocidad pico de la IT).
3. Presión sistólica del VD con defecto septal: Presión sanguínea sistólica sistémica - 4xV2 (velocidad máxima del defecto septal)
4. Presión sistólica de arteria pulmonar = [14 + 145 (TRI VD/TRI VD + TA)2 ]
5. Presión media de arteria pulmonar = [6 + 89 (TRI VD/TRIVD + TA)2 ]
6. Presión diastólica de arteria pulmonar = Presión AD + 4xV2 (de la velocidad pico de la insuficiencia pulmonar al final de la diástole).
7. Qp / Qs = volumen minuto pulmonar / volumen minuto sistémico.
8. Insuficiencia tricuspídea = Área jet IT / Área AD = Leve < 20%, moderada 20-40%, severa > 40%. Dilatación del anillo tricuspídeo = 4 cm, llenado derecho con onda E = 1m/seg., inversión del flujo sistólico en vena hepática.
Diagnóstico ecocardiográfico diferencial de la AE:
La AE debe diferenciarse ecocardiográficamente de la presencia de un amplio espectro de variedades de anomalías del aparato valvular tricuspídeo:
1. Displasia de la válvula tricúspide.
2. Prolapso de la válvula tricúspide.
3. Válvula tricúspide de doble orificio.
4. Válvula tricúspide en paracaídas.
5. Orifico tricuspídeo con ausencia del aparato valvular
6. Atresia tricuspídea por válvula imperforada.
7. Válvula tricúspide encabalgada sobre un septum IV mal alineado.
En un interesante trabajo de Ammash N, Seward y cols. 10 revisaron retrospectivamente 22 pacientes (33 años edad promedio) las característica clínicas y ecocardiográficas más discriminantes que puedan ser de ayuda para identificar correctamente la AE y descartar aquellas que simulan una AE.
Estos pacientes fueron derivados a su centro de estudio con el diagnóstico erróneo de AE. El síntoma más frecuente fué la intolerancia al ejercicio (59%), fibrilo-aleteo auricular (32%), dos con cianosis, Rx. Tórax con cardiomegalia (82%). El diagnóstico referido de AE fué realizado por eco 2d (12 pacientes), cateterismo (cuatro), ambas técnicas (cinco), eco más RNM en un paciente. Todos los pacientes presentaban agrandamiento AD y VD; y disfunción del VD (82%).
Sin embargo la AE fué descartada confiablemente por ecocardiografía repetida usando los siguientes criterios:
1. Ausencia de desplazamiento apical significativo de la valva tricúspide = 8 mm/m2. o más de 20 mm en el adulto.
2. Ausencia de elongación o redundancia de la valva anterior de la tricúspide (100%).
Todos tenían insuficiencia tricuspídea significativa, causada por: displasia de la valva tricúspide, prolapso valvar, trauma, displasia VD, endocarditis, dilatación anular por insuficiencia pulmonar.
De todos los pacientes fueron subsecuentemente sometidos a reparación de valva tricúspide (7 pacientes), o reemplazo valvular (8) y en todos la ausencia de AE fue confirmada.
Finalmente la ausencia de características ecocardiográficas del desplazamiento valvar septal = 8 mm/m2 o de valva anterior redundante, elongada, permitió excluir consistentemente el diagnóstico de AE. (Fig. 7)
En tales circunstancias fueron identificadas consistentemente otras anomalías de la válvula tricúspide o del VD. El reconocimiento de un cuadro que simula una AE tiene importantes implicancias quirúrgicas.
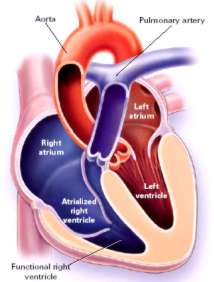
Fig. 7: Paciente adulta con anomalía de Ebstein y VD “atrializado”. Con un VD de tamaño funcional reducido. Las valvas septal e inferior son las que habitualmente se hallan comprometidas.
Muchos pacientes pueden presentar una CIA -tipo OS o FOP- con cortocircuito de derecha a izquierda.
Indicaciones de ecocardiografía Doppler en CC en adultos y fetal: 11
Clase I:
1. Pacientes con sospecha clínica de CC por la presencia de soplo, cianosis, hipoxia, eritrocitosis, electrocardiograma y radiografía compatibles.
2. En pacientes con CC conocida que presentan cambios clínicos en el seguimiento o existen dudas acerca del diagnóstico original, anormalidades estructurales o en la hemodinámica.
3. Ecocardiogramas periódicos para seguimiento de la función ventricular o severidad de las insuficiencias.
4. Pacientes con CC conocida que requieren seguimiento de la presión arterial pulmonar.
5. Seguimiento de cirugía reparadora o paliativa con algunas de las siguientes condiciones: cambios clínicos, sospecha de defectos residuales, función y evaluación del VI, VD, presión pulmonar o historia de hipertensión pulmonar.
Clase III:
1. Estudios eco Doppler repetidos múltiples en reparaciones previas en pacientes con reparaciones previas de conducto arterioso, CIA; CIV o válvula aórtica bicúspide sin cambios en la condición clínica.
El ecocardiograma Doppler transesofágico estaría indicado en caso de mala ventana acústica intercostal o subcostal con el eco transtorácico y son necesarios mayores detalles anatómicos.
Indicaciones de ecocardiograma Doppler fetal en la madre adulta con CC:
Clase I:
1. Sospecha de anormalidad cardíaca en un exámen ecográfico fetal general.
2. Taquicardia, bradicardia, bloqueo AV o ritmo irregular en el exámen clínico fetal.
3. Factores de riesgo maternal/familiar para enfermedades cardiovasculares.
4. Madre con antecedentes de arritmias, diabetes, lupus eritematoso, anomalías cromosómicas.
5. Antecedentes de exposición a teratógeno durante un período vulnerable.
6. Evaluación y reevaluación de terapia transplacentaria.
Clase III:
1. Embarazo de bajo riesgo con anatomía por ecocardiografía normal.
2. Contracciones prematuras ocasionales sin taquicardia sostenida o signos de disfunción o distrés.
3. Presencia de anormalidad cardiovascular cuando la evaluación del sistema CV no alterará las decisiones de manejo o resultado fetal.
CATETERISMO INVASIVO:
Estaría indicado solamente en niños cuando la AE está asociada a CC más complejas en arteria pulmonar o TSVD, con miras a una intervención quirúrgica.
REPERCUSION HEMODINAMICA DE LA AE: 12
En la AE se observa una AD de gran tamaño con miocardio ventricular delgado en su porción inferior: AD con gran llenado, su vaciamiento se dificulta aún más por la resistencia de un VD reducido, y como consecuencia aumenta la presión de la AD con una gran sístole y producción de cortocircuito de derecha a izquierda (por CIA o FO permeable). La porción inferior de a AD posee miocardio ventricular derecho y se contrae en sístole (aunque débilmente) dilatándose e interfiriendo con el llenado ventricular.
· VD pequeño y reducido en su porción de salida (obstrucción valvar): El llenado reducido hace caer el volumen sistólico y el flujo pulmonar, esto agrava la presencia de un IT, de igual modo si la válvula tricúspide es estenótica.
· IT o ET: La presencia de IT o ET agravan el llenado de la AD y reducen el llenado VD. Esto se agrava con la presencia de trastornos de conducción como BAV de 1er grado, BCRD o WPW.
· Tabique IA con CIA o Foramen oval permeable: Desarrollo de cianosis e ICD
¿.. CUALES SON LOS RIESGOS EN MUJERES EMBARAZADAS CON CC ..? 13
El embarazo esta asociado con cambios en el volumen intravascular, volumen minuto y resistencia vascular sistémica. Las CC en embarazadas no complicadas con síndrome de Eisenmenger tienen baja mortalidad. Sin embargo siguen en riesgo para el desarrollo de arritmias, IC o ACV.
Una clase funcional pobre, cianosis y estenosis aórtica significativa han sido repetidamente mencionados como potenciales factores de riesgo para el deterioro cardíaco maternal. 14
La cianosis también es un factor de riesgo para complicaciones en el feto y el neonato. Un estudio reciente reportó una probabilidad de nacimiento del 12 % si la saturación de O2 arterial en reposo se encontraba por debajo de 85%; la tasa de sobrevida mejoraba al 63% cuando la saturación de O2 arterial era = 85%.
En la experiencia de Siu y cols. 15 en 252 embarazadas, fueron identificados los siguientes predictores independientes de eventos cardíacos:
1. Clase cardíaca funcional maternal pobre o cianosis.
2. Historia de ataque isquémico transitorio o insuficiencia cardíaca.
3. Historia de arritmia cardíaca.
4. Obstrucción cardíaca izquierda.
5. Disfunción miocárdica.
Nuevamente Siu y col. 16 desarrollaron y validaron un índice de riesgo para la predicción de complicaciones cardíacas durante el embarazo. Aquí se incluyeron 12 pacientes con AE.
Los 4 predictores de eventos cardíacos primarios fueron:
1. Evento cardíaco previo (IC, ataque isquémico transitorio, ACV previo) o arritmias.
2. Clase II-NYHA basal o cianosis
3. Obstrucción cardíaca previa (Área valvular mitral 2 cm2, Área valvular aórtica 1.5 cm2 o gradiente pico en TSVI 30 mmHg. por eco Doppler).
4. Función sistólica VI reducida con Fey < 40%.
Se utilizó una ecuación de estimación general para validación del tratamiento de cada mujer con CC con más de un embarazo como un evento independiente.
El análisis determinó que embarazos repetidos dentro las mismas madres fueron estadísticamente independientes. Cuando en el análisis fué usado solo el primer embarazo o cuando fueron excluídos los pacientes sin datos del ecocardiograma, los resultados no cambiaron.
No hubo asociación entre eventos cardíacos prepartos y la administración aspirina, anticoagulantes, desde su inicio o con controles de la frecuencia cardíaca o presión arterial. Tampoco hubo asociación entre el tipo de parto. (ver tabla 1 y tabla 2)
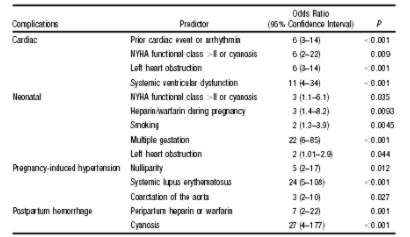
Tabla 1. Complicaciones de CC y sus Odds ratios.
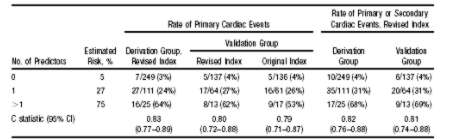
Tabla 2. Exactitud del índice de riesgo.
Este grupo de investigadores concluyen que en mujeres con CC en alto riesgo para eventos cardíacos deberían considerarse intervenciones cardíacas antes de la concepción si el riesgo/ beneficio es favorable.
Mujeres con riesgo cardíaco alto o intermedio (factor de riesgo por lesión cardíaca específica, deberían ser derivadas a un centro de mayor complejidad.
Y aquella con bajo riesgo cardíaco (puntaje 0 o sin factor de riesgo por lesión específica) pueden tener un parto en hospitales de la comunidad.
Las mujeres con factores de riesgo para complicaciones cardíacas maternales o neonatales requerirán una frecuencia aumentada de controles de seguimiento.
Balaji y cols. 17 describieron 6 portadores de AE asociadas a anomalías esqueléticas leves en una familia de 11 integrantes de 3 tres generaciones.
Estas consistían en: extensión limitada de los dedos (manos y pieces), con o sin limitación de las articulaciones mayores y rotación externa del dedo pequeño del pié.
Los hallazgos sugieren un síndrome de Ebstein hereditario dominante y anormalidades esqueléticas. Las cuatro mujeres del grupo con AE fueron afectadas levemente y tres varones con AE fueron afectados severamente
RECURRENCIA, DETECCION Y PREVENCION DE CC. EN EMBARAZADAS Y FETOS: 18
Muchas pacientes llegan a la etapa reproductiva sin estudios genéticos o sin diagnóstico de su AE. Tampoco han recibido consejos disponibles acerca de las causas, herencia, riesgo de recurrencia en el producto del parto, y diagnóstico prenatal. En el estudio genético del adulto con AE es importante.
La historia prenatal y posnatal incluya:
· Exposición maternal a teratógenos (Alcohol, drogas, compuestos con litio)
· Infección viral por Rubeóla.
· DBT mellitus maternal insulino dependiente.
· Historia familiar detallada.
· Examen físico detallado de otras anormalidades asociadas.
Las causas de CC pueden dividirse en:
· Multifactorial
· Desorden de genes simples
· Anormalidades cromosómicas
· Exposición y enfermedades maternales.
Muchas CC son heredadas de manera multifactorial. El riesgo de recurrencia es por lo tanto empírico y es obtenido por estudios familiares con un defecto cardíaco específico.
Así el diagnóstico prenatal y las opciones deben ser discutidos con todos los pacientes con CC. Cuando no hay una causa específica, se recomienda efectuar un ecocardiograma entre la semana de gestación 18 y 20. (Eco Doppler transtorácico, transesofágico o fetal, ver indicaciones más arriba)
Aunque el diagnóstico y tratamiento de las CC son importantes, la prevención de muchas de ellas son posibles y deberían ser discutidas con todas las parejas que contemplan un embarazo.
CIRUGIA DE LA AE, EL RIESGO CARDIOVASCULAR PREQUIRURGICO EN EMBARAZADAS CON CC. Y SUS COMPLICACIONES: 16
Se describen tres técnicas quirúrgicas:
1. Reconstrucción plástica y cierre de la CIA.(técnica preferida)
2. Reemplazo con válvula biológica o mecánica.
3. Reemplazo valvular y reconstrucción cardíaca.
Los objetivos de la cirugía son:
1. Aliviar la regurgitación tricuspídea.
2. Mejorar la función del VD.
3. Eliminar el cortocircuito derecha-izquierda.
4. Seccionar trayectos de cortocircuito AV.
Posteriormente mejora la clase funcional, disminuye la cianosis, la incidencia de arritmias supraventriculares (Ablación por RF prequirúrgica) y el riesgo de embolias paradojales.
Pueden ocurrir arritmias supraventriculares posquirúrgicas (10-20%), pero estas son mejor toleradas y responden mejor al tratamiento farmacológico.
Las anomalías de la válvula tricúspide persisten luego de la operación, como son los grados menores de regurgitación tricuspídea bien toleradas. La mortalidad tardía vinculada con la restitución de la válvula tricúspide es del 10-15%.
Brickner y cols. 19 efectuaron una revisión observando que la reparación o el reemplazo valvular (bioprótesis antes que mecánica) de la tricúspide en conjunción con el cierre de la CIA es recomendada para pacientes mayores con síntomas severos y cardiomegalia a pesar de la terapia médica, debido a que esta condición tiene un pronóstico pobre.
Cuando es posible la reparación valvular es preferible por la baja mortalidad y menor tasa de complicaciones a largo término.
Las complicaciones de la cirugía de corrección de una AE incluyen bloqueo AV completo, persistencia arritmias SV, regurgitación tricuspídea residual pos reparación y disfunción de válvula protésica.
Connolly y cols. 20 estudiaron retrospectivamente el resultado del embarazo en 72 pacientes con AE. De 111 embarazos (44 mujeres) el 76% tuvieron nacidos vivos; 89% por parto vaginal, 23% prematuros, 7 abortos y 2 muertes neonatales.
El peso promedio del RN fue de 2,3 kg (significativamente más bajo que lo normal; p < 0.001).
La incidencia de total de CC de 158 nacidos de entre las portadoras de AE fue del 4% (6/158 nacidos). La incidencia de AE fue del 0.6% (1/158).
No hubo complicaciones maternales serias relacionadas al embarazo (incluidas las muertes, IC, ACV, arritmias o endocarditis).
Concluyen que el embarazo en mujeres con AE es bien tolerado. Está asociado a riesgo incrementado de prematuridad, pérdida del feto o CC en nacidos, bajo peso al nacer comparado con AE acianótica.
Un grupo de investigadores 21 proponen una clasificación de enfermedades cardíacas durante el embarazo, dividiendo en tres grupos de riesgo relacionado con el embarazo:
Grupo I: mortalidad < 1% |
|
CIA sin complicaciones, CIV, Ductus, Enfermedad de la válvula tricúspide o pulmonar, tetralogía de Fallot corregida, EM clase I y II |
|
Grupo II: mortalidad 5-15% |
|
EM con Fibrilación auricular, Válvula mecánica, EM con clase III y IV, Estenosis Ao, Coartación Ao, Fallot no corregido, IAM previo, Síndrome de Marfan con aorta normal. |
|
Grupo III: mortalidad > 15% |
|
Hipertensión pulmonar, Coartación de Ao, Síndrome de Marfan con afección aórtica. |
Tabla 3: Grupos de riesgo en embarazadas. (Kaplan y col.)
EVOLUCION Y PRONOSTICO: 22-24
La intensidad de los síntomas dependerá del tiempo y la severidad de la IT, de la función del VD y de la CIA. Por lo que es probable que transcurra bastante tiempo en forma subclínica hasta la etapa adulta.
Existen reportes que indican que menos del 5% de los pacientes con AE aislada sobreviven más de 50 años y que en la AE asociada a CIA la sobrevida no pasa de los 25 años.
Finalmente los factores de pronóstico adverso son: diagnóstico de AE en la infancia, IC clase III-IV, cianosis por cortocircuito de derecha a izquierda, ICT > 0.65, IT y anomalías asociadas.
BIBLIOGRAFIA
1. Rafes A, Duran M, Brotens D, López C, Conas J. Anomalías de Ebstein de la válvula tricúspide. Ann Esp Pediatr 1996; 44: 139-144.
2. Valdes-Cruz L, Cayré R. Anomalíes of the tricuspid valve and rigth atrium. En: Valdes-Cruz LM, Cayré RO, ed. Echocardiographic diagnosis of congenital heart disease. An embryologic and anatomic approach. Philadelphia, PA: Lippincott-Raven Publishers, 1999: 237-242.
3. Celermayer D, Bull C, Till J, Cullen S, Vassilikos V, Sullivan I, et al. Ebstein’s anomaly: presentation and outcome from fetus to adult. J Am Coll Cardiol 1994; 23:170-6.
4. Robertson D, Silverman N. Ebstein’s anomaly: echocardiographic and clinical features in the fetus and neonate. J Am Coll Cardiol 1989; 14:1300-7.
5. Pavlova M, Fouron J, Drblik S, van Doresburg N, Bigras J, Smallhorn J, et al. Factors affecting the prognosis of Ebstein´s anomaly during fetal life. Am Heart J 1998; 135:1081-5.
6. Robiolo O. Síndrome estetoacústico en la Enfermedad de Ebstein. En: Robiolo AO. Diagnóstico clínico en cardiología. Semiología fisiopatológica. Ed. Intermedica 1ra. Buenos Aires. 1980: 371-373
7. Driscol D, Fuster V, Danielson G: Ebstein´s anomaly of the tricuspid valve En: Emilio Giuliani, de. Mayo Clinic Practice of Cardiology. 3rd. St. Louis: Mosby Year Book Inc. 1996: 1598-1604.
8. Ho S, Goltz D, McCarthy K, Cook A, Connell M, Smith A, Anderson R. The atrioventricular junctions in Ebstein malformation. Heart 2000; 83: 444-449.
9. Mirrakhimov M, Tenenbaum A, Modotashev I, Niazova Z, Zlatkovsky M. New approches to noninvasive assesment of pulmonary artery pressure. Clin Cardiol 1992; 15: 811-816.
10. Piñeiro D, Davolos D, Guerrero F, Killinger C, Roisinblit J. Indicaciones de ecocardiografía en pacientes adultos con cardiopatías congénitas. Migliore R, Grancelli H, Berenztein S, Bustamante Labarta M, Piñeiro D, Marantz P. En Consenso para la aplicacion clínica de ecocardiografía, Consejo de ecocardiografía y Doppler cardíaco. Rev Argent Cardiol Suplemento I; 2000, vol. 68: 38.
11. Ammash N, Warnes C, Connolly H, Danielson G, Seward J. Mimics of Ebstein´anomaly. Am Heart J 1997; 134: 508-513.
12. Liberthson R. Cardiopatías congénitas en el adulto. En: La práctica de la cardiología. Normas del Massachusetts General Hospital. Eagle, Haber Ed. 2da. Panamericana, Buenos Aires. 1991; vol 2: 1183-1190.
13. Shime J, Mockarski E, Hasting D. y col. Congenital heart disease pregnancy: short and long term implications. Am J Obstet Gynecol 1987; 156: 313-322.
14. Presbitero P, Somerville J, Stone S, et al. Pregnancy in cyanotic congenital heart disease. Outcome of mother and fetus. Circulation 1994; 89: 2673-2676.
15. Siu S, Sermer M, Harrison D, y col. Risk and predictors for pregnancy related complications in woman with heart disease. Circulation 1997; 96: 2789-2794.
16. Siu S, Sermer M, Colman J, Alvarez N, Mercier L, Morton B, y col. Prospective multicenter study of pregnancy outcome in woman with heart disease. Circulation. 2001;104:515-521.
17. Balaji S, Dennis N, Keeton B. Familial Ebstein's anomaly: a report of six cases in two generations associated with mild skeletal abnormalities. Heart 1991; 66: 26-28
18. Siu S, Chitayat D, Webb G. Pregnancy in woman with congenital heart defects: ¿.. what are the risks ..?. Heart 1999; 81: 225-226.
19. Brickner M, Hillis D, Ange R. Congenital heart diseases in adult. New Engl J of Med 2000; 342 (5-part 2): 336-337.
20. Connolly H, Warnes C. Ebstein's anomaly: outcome of pregnancy. J Am Coll Cardiol 1994;23(5):1194-8.
21. Kaplan S. Evolución natural y posoperatoria a través de los grupos de edad. Cardiopatías congénitas en adolescentes y adultos. En: Clínicas Cardiológicas de Norteamérica; México, Ed. Interamericana. 1993; vol. 4: 591-592.
22. Silva M, Medeiros So J, Fontes V et al - Anomalia de Ebstein. Arq Bras Cardiol 1983; 40: 133-9.
23. Hong Y, Moller J. Ebstein's anomaly: A long-term study of survival. Am Heart J 1993; 125: 1419-1424.
24. Gentles T, Calder A, Clarkson P, Neutze J. Predictors of long-term survival with Ebstein's anomaly of the tricuspid valve. Am J Cardiol 1992; 69: 377-81.